SEMESTRE 2020-2 grupo 2354
UNIDAD 1
CLASE 1 27 enero 2020 [PRESENTACIÓN Y LINEAMIENTOS, generalidades del curso].
CLASE 2 28 enero 2020 Dispersiones, unidades de concentración, densidad
Hoja de cálculo para obtener densidad ideal y real de mezclas etanol y agua, dar click en la imagen
CLASE 3 30 de enero 2020 Dispersiones, unidades de concentración, interconversión.
Hoja de cálculo para obtener unidades de concentración físicas y químicas, dar click en la imagen
CLASE 4 31 de enero 2020 Dispersiones, clasificación, dispersiones binarias
CLASE 5 4 de febrero 2020 Dispersiones, presión hidrostática y presión osmótica
Hoja de cálculo para obtener densidad real de mezclas NaCl y agua, dar click en la imagen
CLASE 6 6 de febrero 2020 Dispersiones, presión de vapor, soluto no volátil (electrolito y no electrolito)
Hoja de cálculo para obtener propiedades coligativas en agua, dar click en la imagen
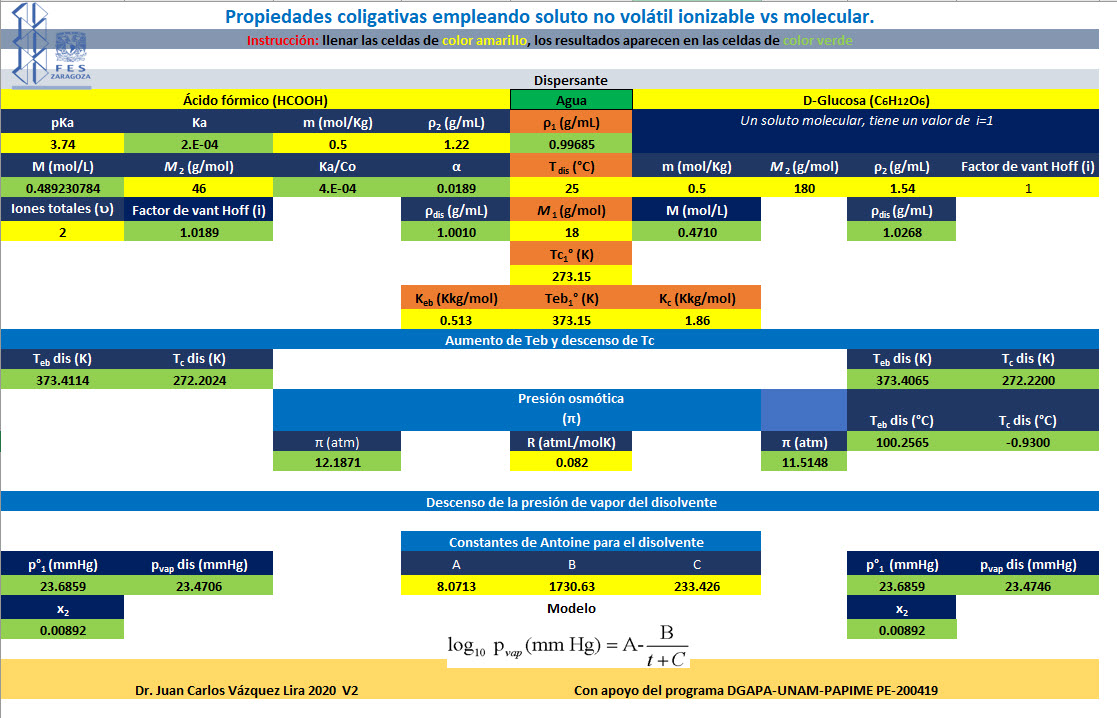
CLASE 7 7 de febrero 2020 Dispersiones, propiedades coligativas, soluto no volátil (electrolito y no electrolito)
Hoja de cálculo para obtener propiedades coligativas en diferentes disolventes, dar click en la imagen
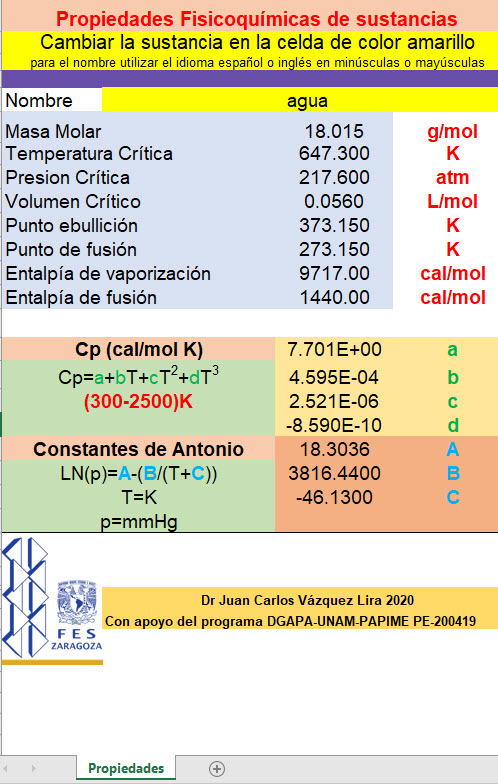
CLASE 8 11 de febrero 2020 Dispersiones reales, propiedades coligativas, soluto no volátil (electrolito y no electrolito, ejercicios de aplicación)
acceso a propiedades de sustancias, dar click en la imagen
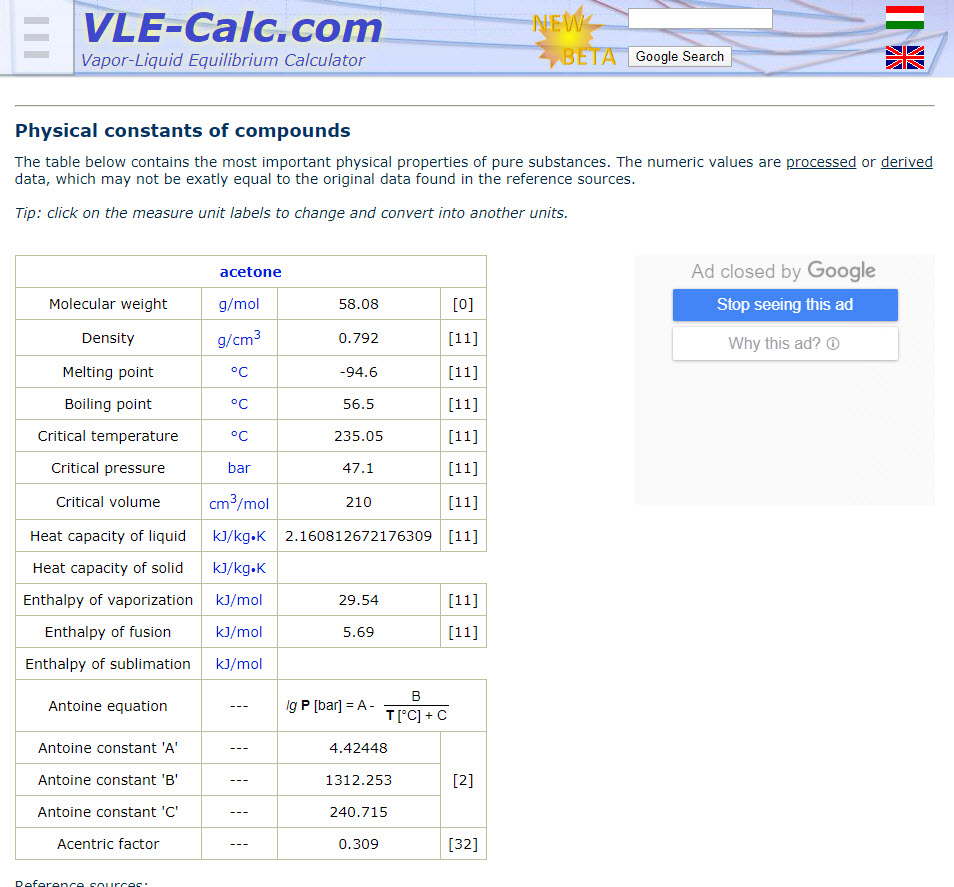
CLASE 9 13 de febrero 2020 Dispersiones reales, propiedades coligativas, soluto no volátil (electrolito y no electrolito, ejercicios de aplicación)
Base de datos para propiedades termodinámicas de sustancias, dar click en la imagen
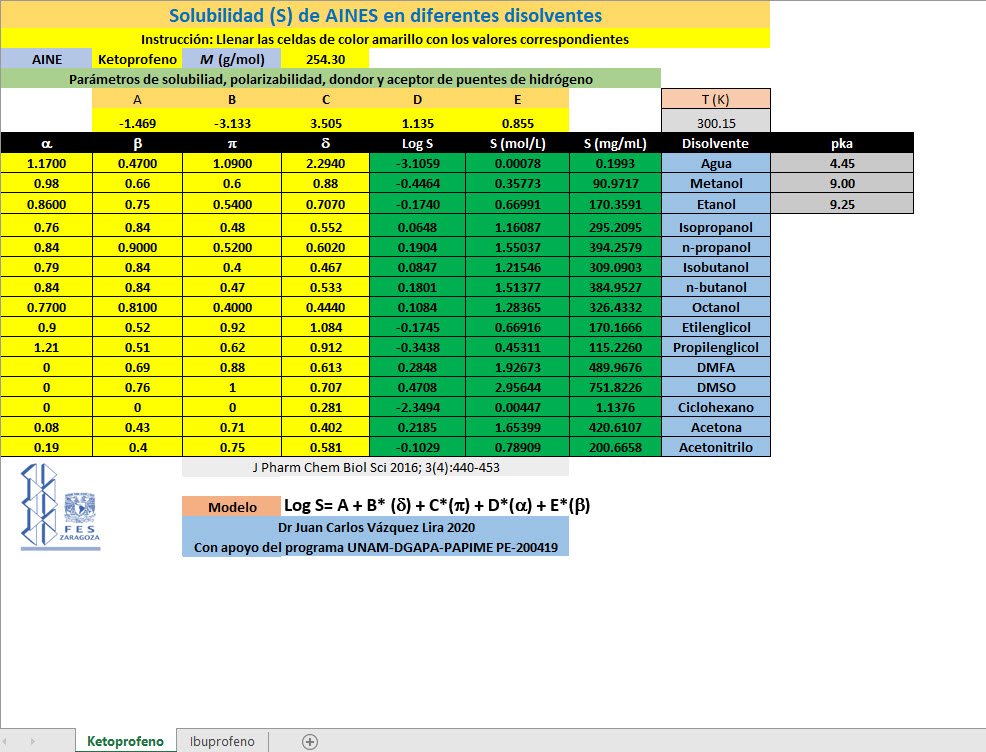
CLASE 10 14 de febrero 2020 Dispersiones ideales, soluto volátil, ley de Raoult)
Hoja de cálculo para determinar solubilidad de AINES en diferentes disolventes, dar clic en la imagen
CLASE 11 17 de febrero 2020 Equilibrio solido-sólido y sólido líquido- mezclas frigoríficas. Diagrama de fases. Regla de las fases.
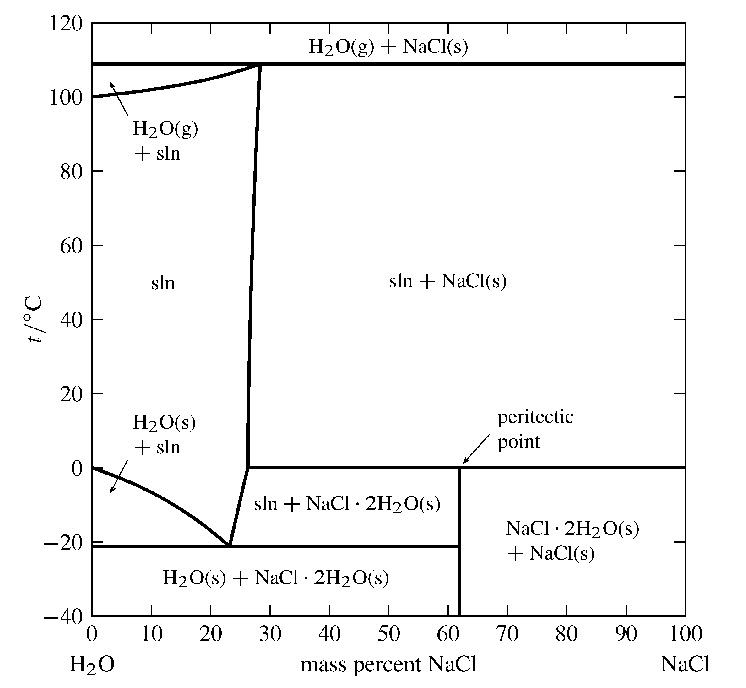
Diagrama de fases NaCl-Agua, dar clic en la imagen
CLASE 12 18 de febrero 2020 Equilibrio solido-sólido (inmiscibilidad total) y sólido-líquido. Diagrama de Fases. Regla de la palanca
Hoja de cálculo para obtener coordenadas de punto eutéctico simple en mezcla binaria, dar clic en la imagen

CLASE 13 20 de febrero 2020 Equilibrio solido-sólido (miscibilidad total y parcial) y sólido-líquido. Diagrama de Fases. Regla de la palanca
Hoja de cálculo para obtener balance de materia aplicando la regla de la palanca en mezcla binaria, dar clic en la imagen
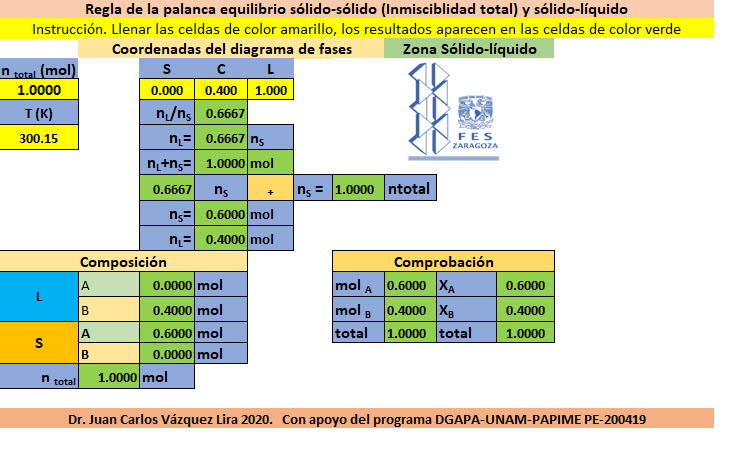
CLASE 14 21 de febrero 2020 Equilibrio solido-sólido (miscibilidad total y parcial) y sólido-líquido. Diagrama de Fases. Regla de la palanca
Hoja de cálculo para obtener balance de materia aplicando la regla de la palanca en mezcla binaria, dar clic en la imagen
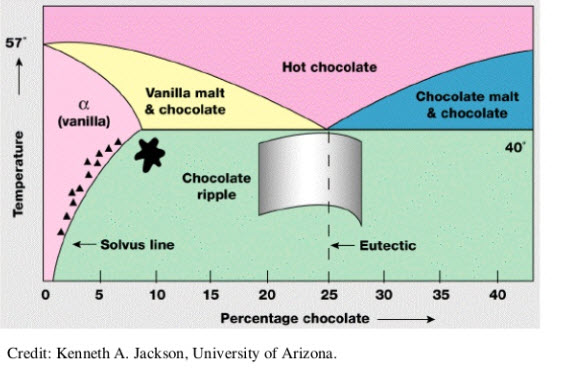
Diagrama de fases de chocolate y vainilla, dar clic en las imágenes
CLASE 15 24 de febrero 2020 Equilibrio solido-sólido (miscibilidad total), sólido-líquido y líquido-líquido (miscibilidad total). Diagrama de Fases. Regla de la palanca
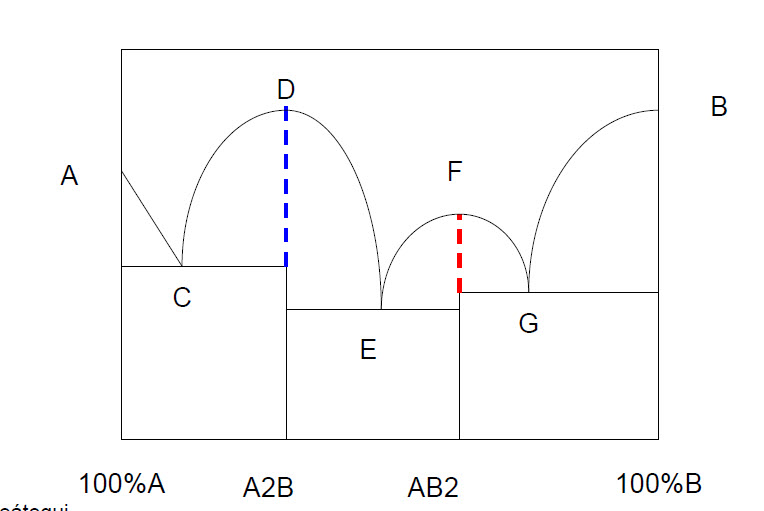
Hoja de cálculo para obtener balance de materia aplicando la regla de la palanca en mezcla binaria con formación de compuesto, dar clic en la imagen

CLASE 16 25 de febrero 2020 Equilibrio solido-sólido (inmiscibilidad total) y líquido-líquido (miscibilidad total). Formación de compuesto. Punto de fusión congruente. Diagrama de Fases. Regla de la palanca
CLASE 17 27 de febrero 2020 Equilibrio solido-sólido (inmiscibilidad total) y líquido-líquido (miscibilidad total). Formación de compuesto. Punto de fusión incongruente.
Equilibrio L-L miscibilidad parcial. Diagrama de Fases. Regla de la palanca
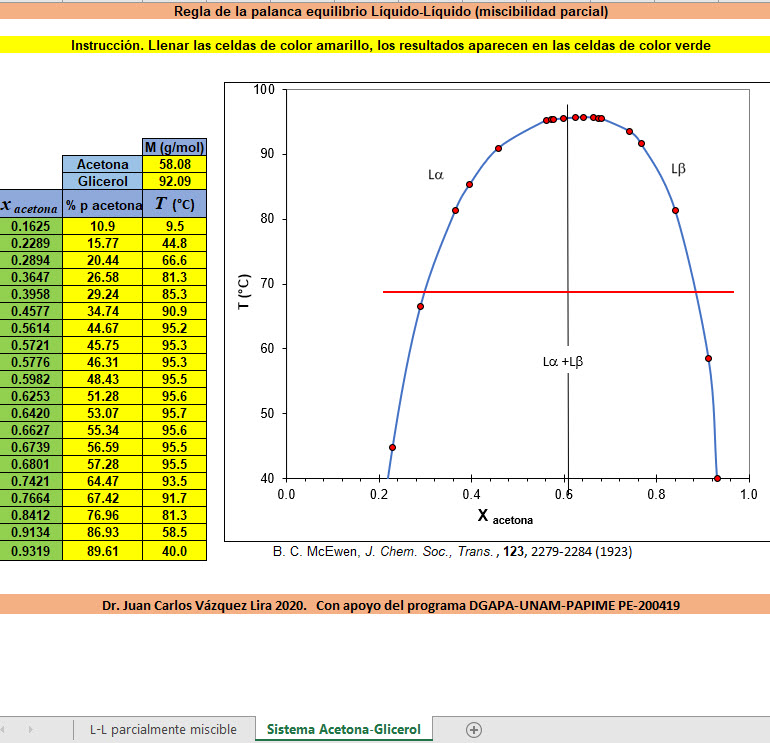
Hoja de cálculo para obtener balance de materia aplicando la regla de la palanca en mezcla binaria equilibrio L-L parcialmente miscible, dar clic en la imagen
CLASE 18 28 de febrero 2020 Equilibrio L-L miscibilidad parcial
CLASE 19 2 de marzo 2020 Equilibrio L-L y L-V ideal Ley de Raoult y Dalton
Hoja de cálculo para obtener diagrama a T=cte en mezcla binaria equilibrio L-L y L-V ideal, dar clic en la imagen
CLASE 20 3 de marzo 2020 Equilibrio L-L y L-V ideal Ley de Raoult y Dalton
Hoja de cálculo para obtener punto de rocío y burbuja, diagrama a T=cte en mezcla binaria, dar clic en la imagen
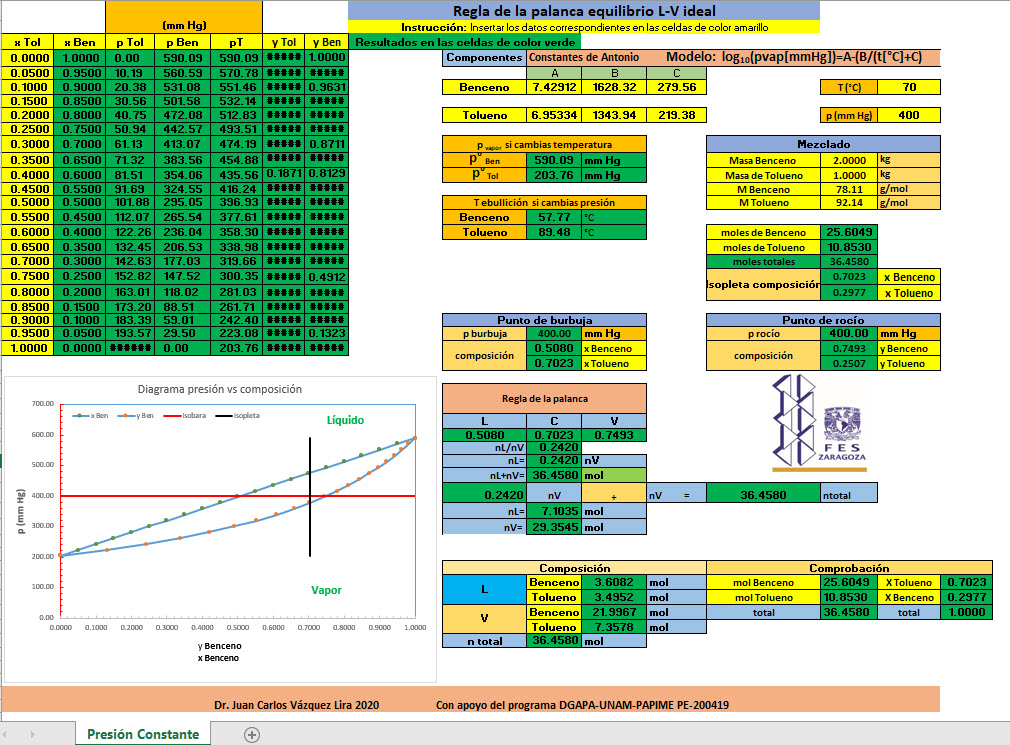
CLASE 21 5 de marzo 2020 Equilibrio L-L y L-V ideal Ley de Raoult y Dalton
Hoja de cálculo para obtener composición aplicando la regla de la palanca, diagrama a T=cte en mezcla binaria, dar clic en la imagen
CLASE 22 6 de marzo 2020 Equilibrio L-L y L-V ideal Ley de Raoult y Dalton
Hoja de cálculo para obtener diagrama T vs composición en mezcla binaria ideal
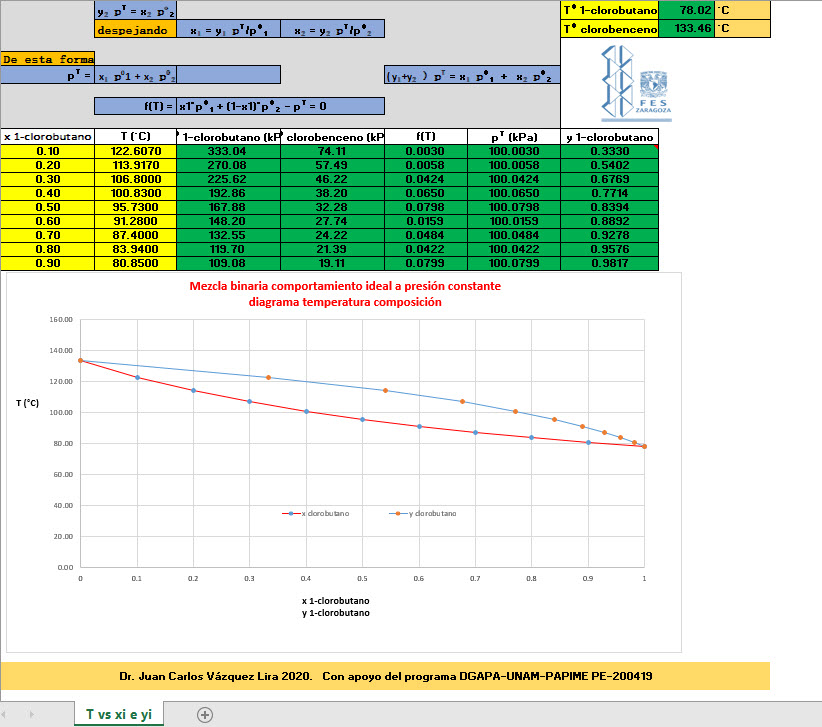
CLASE 23 9 de marzo 2020 Equilibrio L-L y L-V ideal Ley de Raoult y Dalton
Hoja de cálculo para obtener diagrama T vs composición en mezcla binaria ideal y aplicación de la regla de la palanca,dar clic en la imagen.
CLASE 24 10 de marzo 2020 Desviación de la idealidad equilibrio L-V
Hoja de cálculo para calcular actividad y coeficiente de actividad en una mezcla binaria real, dar clic en la imagen.
CLASE 25 12 de marzo 2020 Desviación de la idealidad equilibrio L-V, fugacidad y actividad. Repaso interactivo de diagramas de fase
CLASE 26 13 de marzo 2020 Destilación método Mac-Cabe Thiele
CLASE 27 17 de marzo 2020 Destilación por arrastre de vapor. Diagramas Ternarios
acceso a hoja de cálculo para destilación por arrastre de vapor
dar clic en la imagen
CLASE 28 19 de marzo 2020 Diagramas Ternarios
acceso a software para dibujar diagramas ternarios, dar clic en la imagen, se registran y la descarga es gratuita

CLASE 29 20 de marzo 2020 Diagramas Ternarios
acceso a simuladores para diagramas ternarios , dar clic en cada imagen

UNIDAD 2
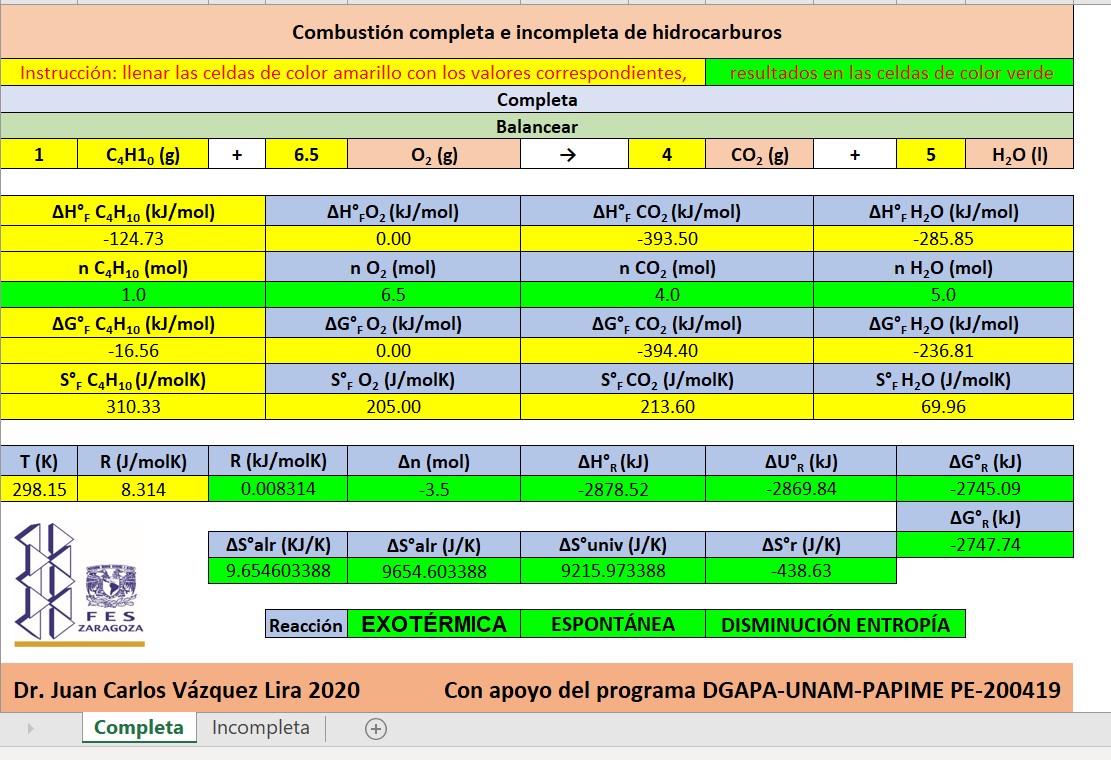
CLASE 30 2CLASE 30 23 de marzo 2020 Termoquímica. Ecuaciones termoquímicas, convención de signos, reglas, tipos de energía asociada a una reacción
Hoja de cálculo para reacciones completas e incompletas de combustión, dar clic en la imagen
Tarea: comparar la combustión completa e incompleta de etano y propano con la del butano, los resultados compararlos contra cálculos manuales y discutir lo obtenido, se entrega el 25 de marzo
Tablas termodinámicas como material de apoyo, dar clic en cada documento
| Tablas termodinámicas 1 |
| Tablas termodinámicas 2 |
| Tablas termodinámicas 3 |
| Tablas termodinámicas 4 |
| Tablas termodinámicas 5 |
| Tablas termodinámicas 6 |
Los coeficientes estequiométricos siempre se refieren al número de moles de una sustancia que reaccionan para dar el incremento de entalpía correspondiente.
Cuando se invierte una ecuación, la magnitud de ΔH se mantiene igual, pero cambia el signo. Es decir, si una reacción es endotérmica, la reacción inversa debe ser exotérmica y viceversa
Si se multiplican ambos lados de una ecuación termoquímica por un factor n, ΔH también se debe multiplicar por el mismo factor.
Cuando se escriben ecuaciones termoquímicas, siempre se debe especificar el estado físico de todos los reactivos y productos, porque esto ayuda a determinar el cambio real de entalpía.
El estado normal de una sustancia, para la termodinámica, es su estado más estable a la presión de 1 atm y a alguna temperatura especifica (25°C o 298.15 K a menos que se especifique otra temperatura). El calor normal de formación es la variación de entalpía que se produce cuando se forma un mol de un compuesto a partir de sus elementos en su estado más estable a una presión de una atm y 25°C
Por convención, el calor de formación de cualquier elemento en su forma más estable es cero.
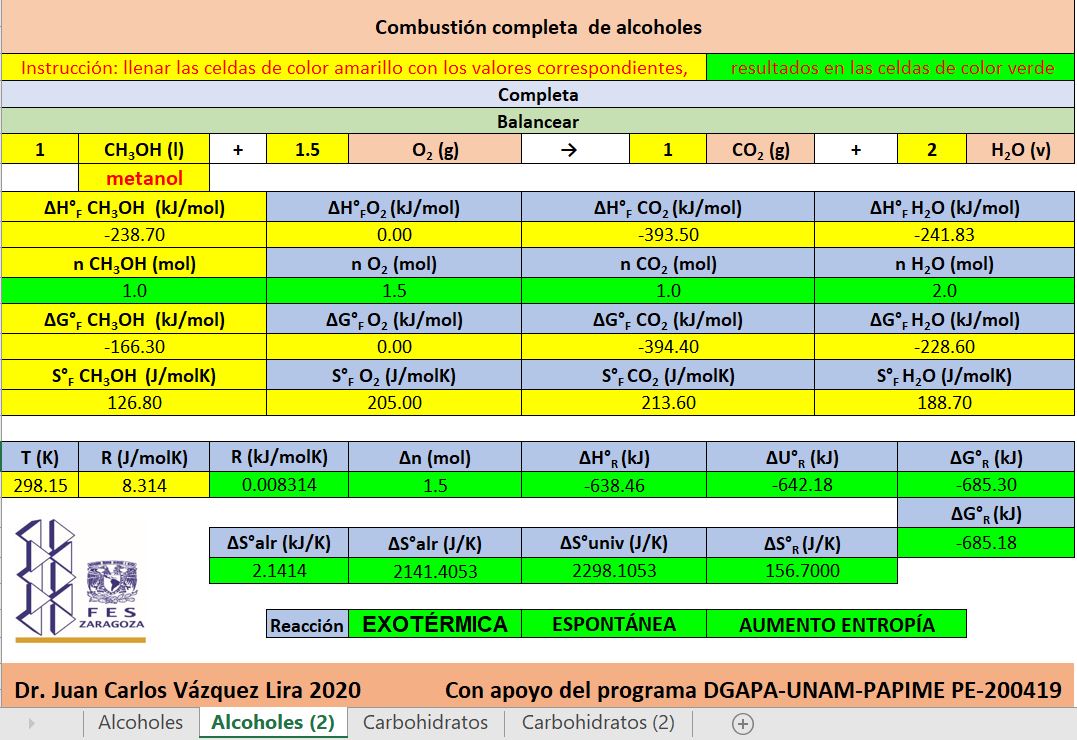
CLASE 31 24 de marzo 2020 Termoquímica. Energía de enlace. Energías de formación. Combustión.
Hoja de cálculo para reacciones de combustión de alcoholes y carbohidratos, dar clic en la imagen
Tarea: comparar la combustión completa de metanol, etanol y n.-propanol. Por otro lado comparar la combustión de sacarosa cuando se forma agua liquida por un lado y vapor de agua por otro lado, los resultados compararlos contra cálculos manuales y discutir lo obtenido, se entrega el 26 de marzo
CLASE 32 26 de marzo 2020. Termoquímica. Reacciones completas e incompletas. Reacciones endotérmicas y exotérmicas. Ley de Hess
Hoja de cálculo para obtener entalpía de reacción a partir de energías de enlace, dar clic en la imagen
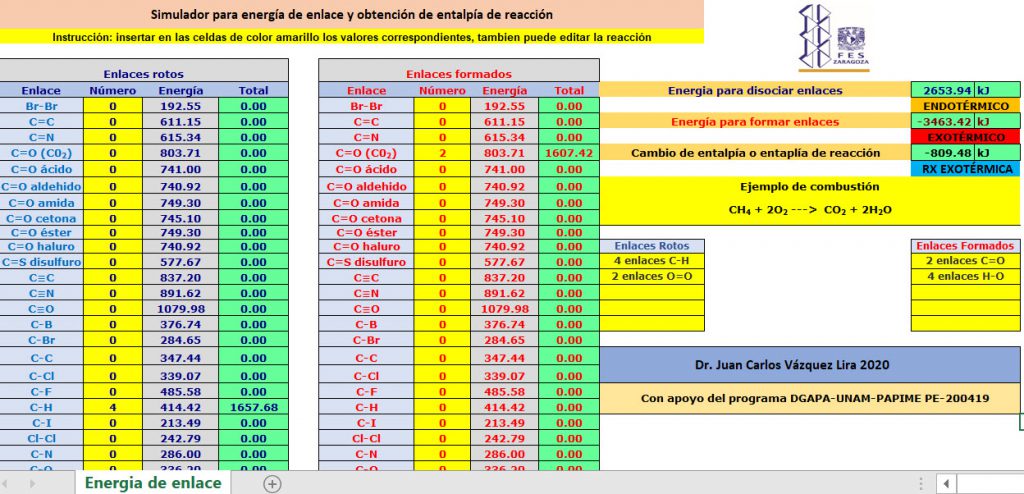
Tarea: Calcular la entalpía de reacción utilizando energías de enlace y entalpías de formación para las siguientes reacciones:
- reacción completa de combustión del metanol
- reacción de halogenación del metano
- reacción de hidrogenación del eteno
- Proceso Haber-Bosh para obtener amoniaco
se entrega el 27 de marzo
CLASE 33 27 de marzo 2020. Termoquímica. Ciclo de Born-Haber (simulador) y ley de Hess (revisión)
CLASE 34 30 de marzo 2020. Termoquímica. Ley de Hess (simulador)
Simulador para obtener entalpía de formación por el ciclo de Born-Haber, dar clic en la imagen
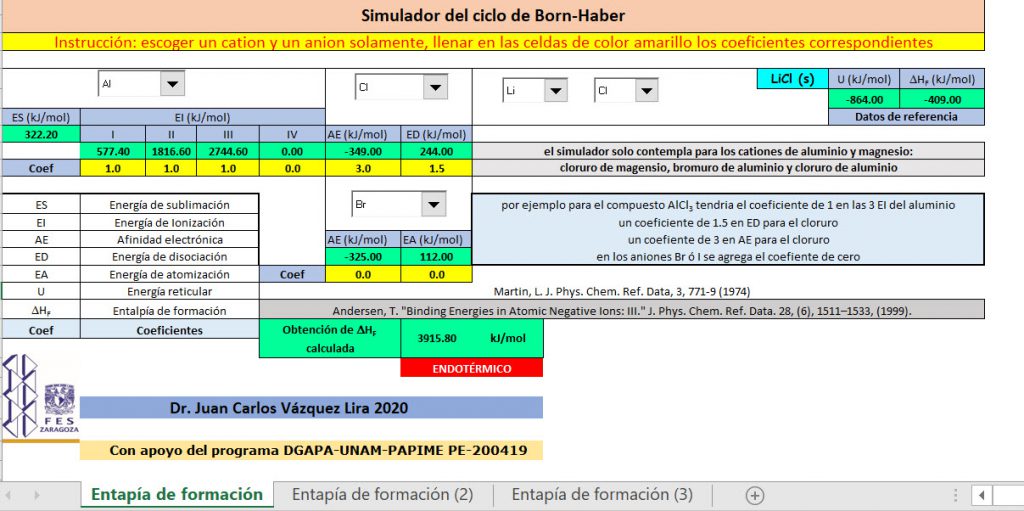
Tarea: Calcular y dibujar el ciclo de Born-Haber para al menos 3 ó 4 compuestos, de los resultados relacionarlos con la solubilidad en agua y punto de fusión, por ejemplo pueden comparar todos los cloruros, LiCl, NaCl, KCl, RbCl, CsCl2 MgCl2 y AlCl3. Otra opción es comparar KCl, MgCl2 y ALCl3, otra opción es comparar bromuros LiBr, NaBr, KBr, RbBr, CsBr y ALBr3, otra opción es comparar KF, KCl, KBr y KI, otra opción es comparar LIF, LiCl, LiBr y LiI, otra opción es comparar NaF, NaCl, NaBr y NaI.
Ejemplo para identificar los diferentes tipos de energía en el ciclo de Born-Haber
| PROCESO | CAMBIO DE ENERGÍA (kJ/mol) |
| Li(s) –> Li(g) | 161 |
| Li(g) –> Li+(g)+e– | 520 |
| (1/2)F2(g) –> F(g) | 77 |
| F(g) –> F–(g) | -328 |
| Li+(g)+F–(g) –> LiF(s) | -1047 |
| SUMA | -617.0 (por mol de LiF) |
| Li(s)+(1/2)F2(g) –> LiF(s) |
Recuerden a mayor complejidad de comparación son máximo 3 puntos de la tarea, sí compara todos los cloruros y todos los bromuros y 1 punto extra por justificar los resultados del simulador de forma manual. Se entrega el 31 de marzo, máximo 2 de la tarde
CLASE 35 31 de marzo 2020. Energía de solución (dispersión homogénea), Ley de Hess.
Simulador para obtener entalpía de solución o dispersión homogénea, dar clic en la imagen
Tarea: Utilizar el anterior simulador y discutir que significa la energía de solución y el efecto de la temperatura en la solublidad de cada compuesto que se pueda disolver
Se entrega el 1 de abril, máximo 2 de la tarde
CLASE 36 2 de abril 2020. Efecto de la temperatura en la energía de reacción (simulador)
Simulador para calcular el efecto de la temperatura en la energía de una reacción a presión constante, dar clic en la imagen.
Tarea: Utilizar el anterior simulador y discutir que efecto tiene la temperatura en la entalpia, energía interna, entropía y energía libre de Gibbs, contrastar con cálculos manuales para los siguientes reacciones:
1). Formación de amoniaco
2). Combustión de acetona con formación de vapor de agua
Se entrega el 3 de abril, máximo 2 de la tarde
CLASE 37 3 abril 2020. Equilibrio químico. Ley de acción de masas. Principio de Lechatelier. Equilibrio homogéneo y heterogéneo. (solo revisión)
CLASE 38 13 abril 2020.
Equilibrio químico. Ley de acción de masas. Principio de Lechatelier. Equilibrio homogéneo y heterogéneo. (Lecturas. Primera parte)
Actividad: lecturas que servirán para enriquecer la discusión al utilizar los simuladores en equilibrio químico. Es muy importante su lectura y la generación de un apunte en su libreta
| El concepto del equilibrio químico | dar clic para descargar |
| Constante termodinámica de equilibrio | dar clic para descargar |
| Errores conceptuales de equilibrio químico | dar clic para descargar |
CLASE 39 14 abril 2020.
Ley de acción de masas. Principio de Lechatelier. Equilibrio homogéneo y heterogéneo. (Lecturas Segunda parte)
Actividad: lecturas que servirán para enriquecer la discusión al utilizar los simuladores en equilibrio químico. Es muy importante su lectura y la generación de un apunte en su libreta
| ¿Tiene unidades la constante de equilibrio? | dar clic para descargar |
| Grado de avance | dar clic para descargar |
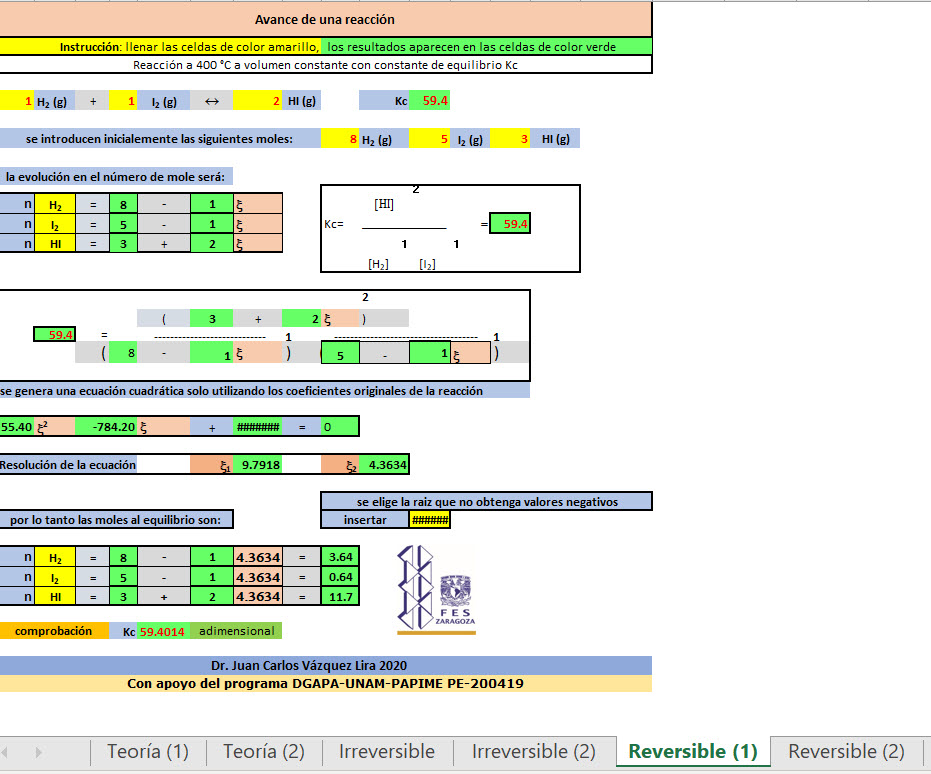
CLASE 40 16 abril 2020. Equilibrio químico homogéneo. Efecto de la presión. Constante de equilibrio. Kc (simulador)
Simulador para calcular el avance de una reacción irreversible y reversible a temperatura constante, dar clic en la imagen
Tarea: Utilizar el anterior simulador y discutir como afectan algunas variables de acuerdo al tipo de reacciones
En la reacción irreversible
1). Como afectan las moles de inicio de los reactivos para determinar reactivo limitante y obtener el avance de reacción
2). Como afectan las moles de inicio de productos y el agregado de más moles de reactivos en la obtención del balance de materia final y la identificación del reactivo limitante
comprobar con cálculos manuales
En las reacciones reversibles
1). Determinar como afectan las moles de reactivos y productos en el equilibrio químico, discutir el desplazamiento de la reacción (Reacción 1)
2). Determinar como afectan las moles de reactivo y producto en el equilibrio químico discutir el desplazamiento de la reacción (Reacción 2)
3). Determinar como afecta el volumen en el desplazamiento del equilibrio (Reacción 2)
en ambas reacciones reversibles discutir de acuerdo al principio de Lechatelier
comprobar con cálculos manuales
Se entrega el 17 de abril, máximo 2 de la tarde
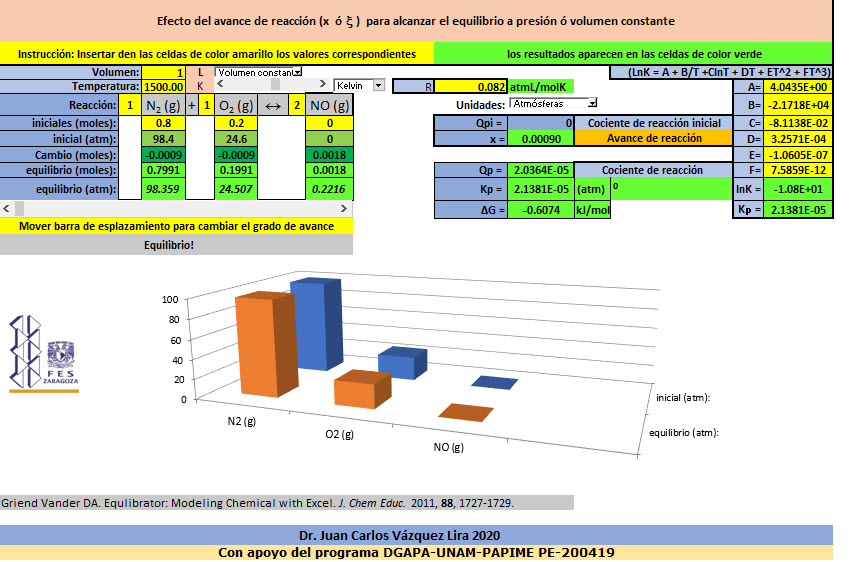
CLASE 41 17 abril 2020. Equilibrio químico heterogéneo. Efecto de la temperatura. Constante de equilibrio. Kc y Kp (simulador)
Simulador para obtener Kc y Kp a volumen y presión constante, dar clic en la imagen
Tarea: Utilizar el anterior simulador y discutir como afecta, la presión, el volumen y la cantidad de materia en el desplazamiento del equilibrio, utilizar la herramienta de barra de desplazamiento y las barras de selección, contrastar con cálculos manuales: Son 2 reacciones independientes en equilibrio homogéneo
Se entrega el 20 de abril, máximo 2 de la tarde
CLASE 42 20 abril 2020. Equilibrio químico homogéneo y heterogéneo. Constante de equilibrio.
Actividad: lecturas que servirán para enriquecer la discusión al utilizar los simuladores en equilibrio químico. Es muy importante su lectura y la generación de un apunte en su libreta
| Utilización del concepto de equilibrio homogéneo y heterogéneo | dar clic para descargar |
| Más sobre equilibrio químico | dar clic para descargar |
CLASE 43 21 abril 2020. Equilibrio químico homogéneo y heterogéneo. Ejercicios y simuladores
Actividad: lecturas que servirán para enriquecer la discusión al utilizar los simuladores en equilibrio químico. Es muy importante su lectura y la generación de un apunte en su libreta
| Utilización de hojas de cálculo para obtener condiciones al equilibrio. Grado de ionización. | dar clic para descargar |
| Más sobre cociente de reacción | dar clic para descargar |
| Interpretación del efecto de T en el equilibrio | dar clic para descargar |
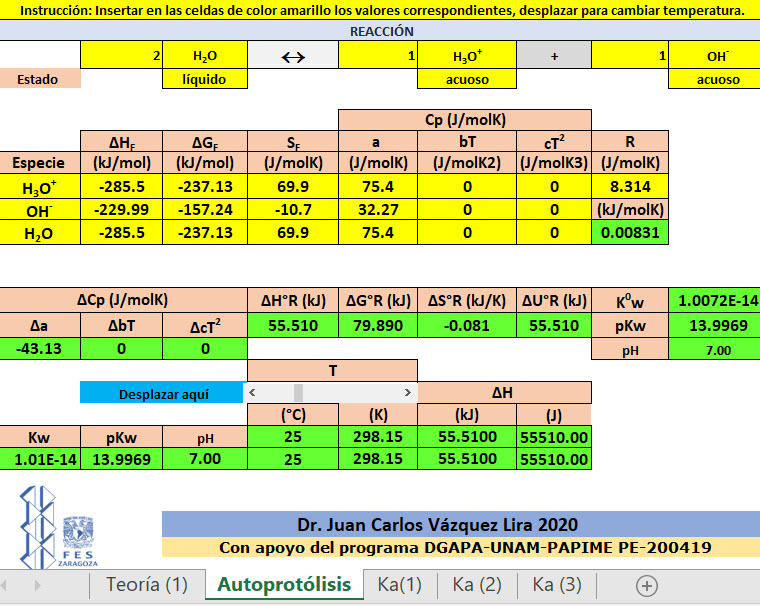
CLASE 44 23 abril 2020. Equilibrio químico homogéneo. Efecto de la temperatura. Constante de equilibrio. Ejercicios y simuladores.
Simuladores para obtener el efecto que tiene la temperatura en la k cinética , dar clic en la imagen
Tarea: Utilizar el anterior simulador y discutir y justificar con cálculos manuales como la temperatura influye en la autoprotólisis del agua, es decir como cambia Kw y el pH. Relacionar el balance de energía
En la otra parte del simulador discutir y justificar con cálculos manuales como cambia Ka del ácido acético por efecto de la temperatura.Relacionar también el balance energético
Por otro lado también discutir y justificar con cálculos como se afecta el grado de ionización en el ácido acético por efecto de la concentración y pH. El valor de Ka ó pka es calculado en la hoja Ka(1), consideren esta observación.
Se entrega el 24 de abril, máximo 2 de la tarde
CLASE 45 24 abril 2020. Equilibrio químico heterogéneo. Constante de equilibrio. Ejercicios y simuladores.
Simulador para obtener Ky, Kp y Kc en equilibrio heterogéneo, dar clic en la imagen
Tarea: Utilizar el anterior simulador y obtener Ky, Kp y Kc, justificar con cálculos manuales.
Discutir de acuerdo al principio de Lechatelier que sucede al cambiar volumen y cantidad de materia, realizar un perfil comparativo, registrando estos cambios en tablas.
Se entrega el 27 de abril, máximo 2 de la tarde
CLASE 46 27 abril 2020. Entrega de la última tarea del a unidad 2. Revisión de apuntes para el examen de la unidad 2.
CLASE 47 28 abril 2020. Examen Unidad 2. Aula virtual.
Siga las instrucciones aquí
https://blogceta.zaragoza.unam.mx/fisico-qa/aula-virtual/
UNIDAD 3
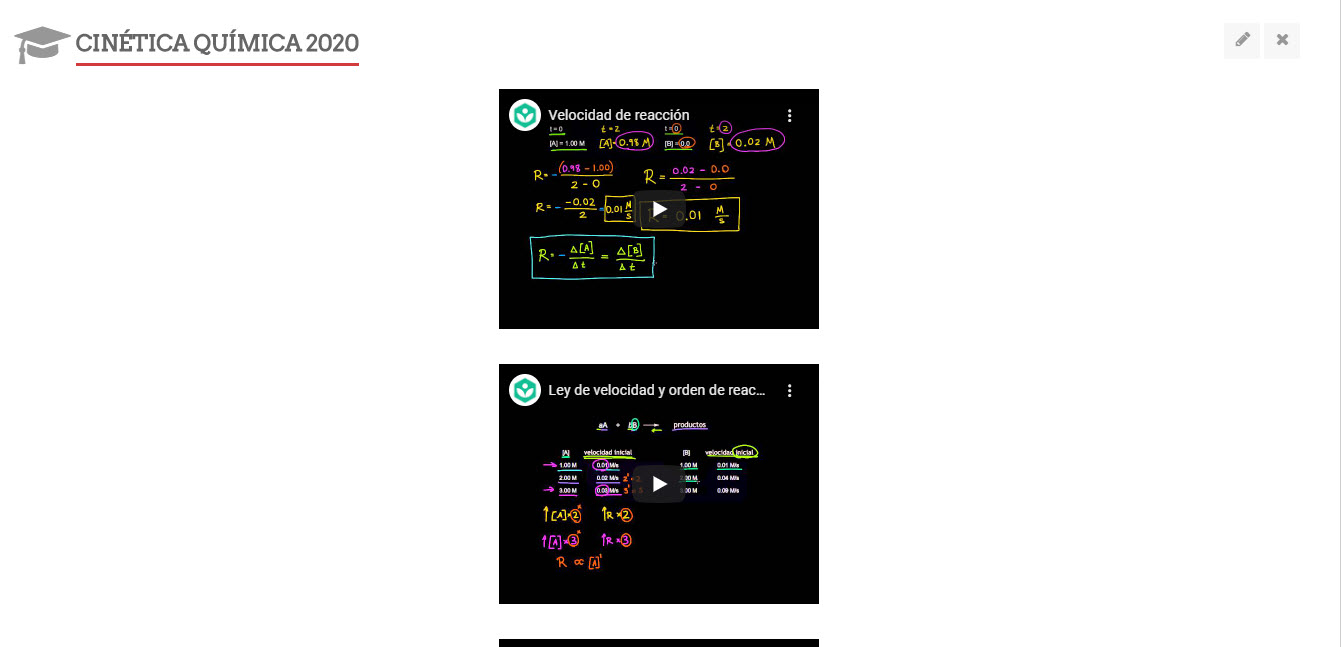
CLASE 48 4 mayo 2020. Generalidades de cinética química. Velocidad de reacción. Molecularidad. Revisión de información.
Actividad: videos que servirán para enriquecer la discusión al utilizar los simuladores en cinética química. Los videos se encuentran el aula virtual, por lo menos revisar los primeros dos (velocidad de reacción, ley de velocidad y orden de reacción). Es muy importante su lectura y la generación de un apunte en su libreta
CLASE 49 5 mayo 2020. Generalidades de cinética química. Velocidad de reacción. Molecularidad. Revisión de información.
Actividad: Revisar la siguiente presentación y profundizar en los temas de velocidad de reacción, orden de reacción y molecularidad. Es muy importante su lectura y la generación de un apunte en su libreta.
dar clic en la siguiente imagen para descargar el material
CLASE 50 7 mayo 2020. Generalidades de cinética química. Orden 0, Orden 1 y Orden 2.
Actividad: videos que servirán para enriquecer la discusión al utilizar los simuladores en cinética química. Los videos se encuentran el aula virtual, revisar (orden 0, oren 1 y orden 2). Es muy importante su lectura y la generación de un apunte en su libreta.
Revisar de la presentación anterior los temas del día de hoy.
CLASE 51 8 mayo 2020. Primer simulador de cinética química
Tarea: Utilizar el siguiente libro en cinética que incluye 3 simuladores y determinar:
- En velocidad de reacción verificar velocidad promedio, velocidad instantánea y el orden reacción del re-arreglo del metil-isonitrilo, discutir las gráficas y obtener de forma manual los resultados.
- En la parte de orden de reacción, discutir cual es el mejor orden de reacción y obtener de forma manual las comparaciones con otros ordenes.
- En la parte de comparación, discutir como afecta el cambiar la concentración inicial de A y la k de velocidad en los diferentes órdenes de reacción. Determinar el alcance del simulador, discutiendo de forma gráfica todas las comparaciones posibles.
Se entrega el 11 de mayo, máximo 2 de la tarde
dar clic en la imagen para descargar el libro
CLASE 52 11 mayo 2020. Generalidades de cinética química. Reacciones reversibles.
Actividad: Revisar tiempo de vida media, aplicaciones y realizar un apunte
CLASE 53 12 mayo 2020. Generalidades de cinética química. Efecto de la temperatura
Tarea: Utilizar el siguiente libro que contiene 2 simuladores en cinética química y determinar:
- Orden de reacción y tiempo de vida media para la velocidad de reacción de Magnesio y HCl (realizado en Ciencia básica 1), justificar cada uno de los cálculos de reacción aplicarlos en esta primera parte del libro.
- Con los resultados que obtuvieron en velocidad de reacción en Ciencia básica 1 aplicarlos en este simulador.
- En el segundo simulador justificar manualmente la obtención de orden de reacción a partir de tiempos de vida media.
- Aplicar el segundo simulador con estos datos experimentales que es la dimerización de un óxido de nitrilo 2A — A2.
Se entrega el 14 de mayo, máximo 2 de la tarde
dar clic en la imagen para descargar el libro
CLASE 54 14 mayo 2020. Generalidades de cinética química. Estabilidad
Tarea: Utilizar el siguiente libro que contiene 3 simuladores en cinética química y determinar lo siguiente:
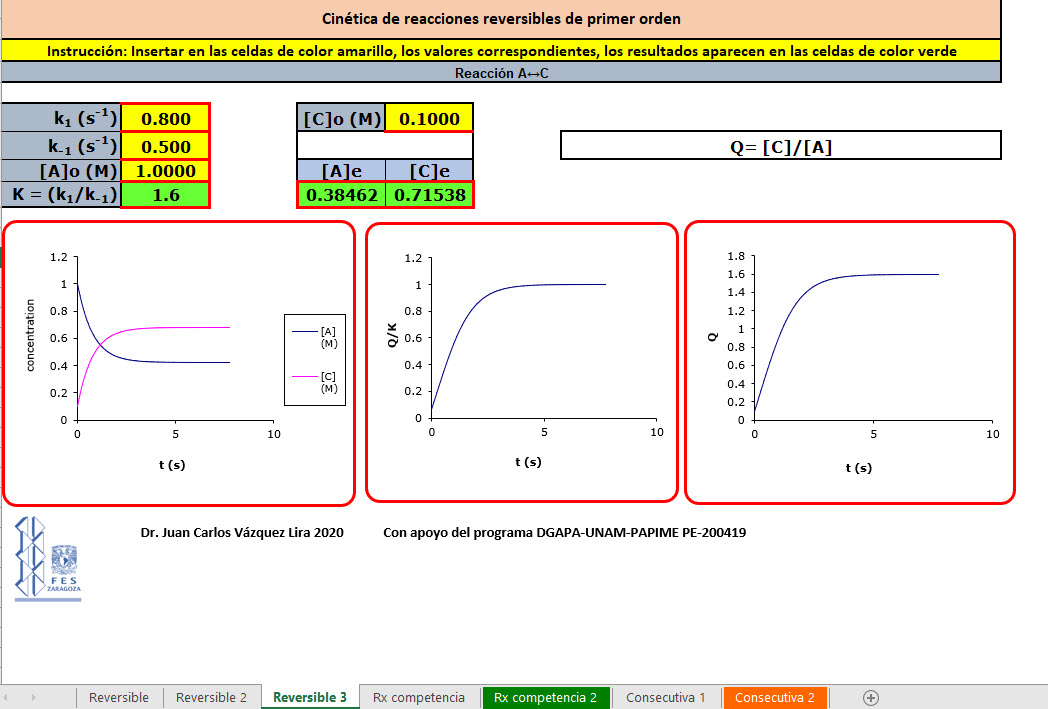
- En la cinética de reacciones en equilibrio de primer orden, determinar el efecto de la concentración y las k cinéticas, comparar gráficamente y discutir las observaciones, comprobar con cálculos manuales las concentraciones al equilibrio, el valor de K y Q. Se emplea el primer simulador.
- En la cinética de reacciones de competencia de primer orden, determinar el efecto de la concentración y de las k cinéticas, comparar gráficamente y discutir las observaciones. Se emplea el segundo simulador.
- En la cinética de reacciones consecutivas de primer orden, determinar el efecto de la concentración y de las k cinéticas, comparar gráficamente y discutir las observaciones. Se emplea el tercer simulador.
- Se anexa la mejor bibliografía como soporte para toda la unidad en cinética, solo es el capítulo 18, dar clic en la imagen
dar clic en la imagen para descargar el libro
Se entrega el 18 de mayo, máximo 2 de la tarde
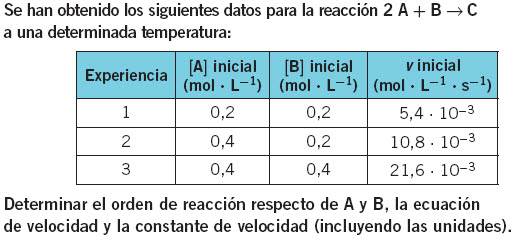
CLASE 55 18 mayo 2020. Generalidades de cinética química. Método de las velocidades iniciales
Tarea: Utilizar el siguiente libro que contiene 2 simuladores en cinética química y determinar lo siguiente:
- Justificar con cálculos manuales el orden de reacción global para cada simulador, agregar observaciones
- Aplicar cualquiera de los dos simuladores para resolver el siguiente problema:
3. Calcular la v inicial cuando A= 0.3 M y B=0.35M
dar clic en la imagen para descargar el libro
Se entrega el 19 de mayo, máximo 2 de la tarde
CLASE 56 19 mayo 2020. Generalidades de cinética química.Efecto de la temperatura. Ecuación de Arrhenius.
Tarea: Utilizar el siguiente libro que contiene 3 simuladores en cinética química y determinar lo siguiente:
- Justificar manualmente los resultados para cada simulador
- Discutir ampliamente lo que se observa en los resultados, sobre todo lo del factor de frecuencia (A) y la energía de activación (Ea)
- Que efecto tiene la temperatura en la k cinética.
- Que efecto tiene k cinética en reacciones en equilibrio, que efecto tiene la temperatura en la Keq (recordar la unidad 2.)
- En el último simulador se ejemplifica una aplicación en cinética química para obtener fecha de caducidad de medicamentos, discutir el resultado y para que nos sirve el realizar estudios de estabilidad acelerada.
Se entrega el 21 de mayo, máximo 2 de la tarde
CLASE 57 21 mayo 2020. Generalidades de cinética química. Aplicaciones
Trabajo final: Pude utilizar cualquier simulador de la unidad o generar uno diferente, se deberá entregar un ejemplo de aplicación en cinética química para el área Químico-Biológica, puede ser en:
- Estabilidad de medicamentos
- Cinéticas de fotólisis.
- Cinética de hidrólisis.
- Cinética ambiental.
- Aplicación para el área Bioquímica.
- Mecanismos de reacción.
Recuerde justificar bien su propuesta
Se entrega el 22 de mayo, máximo 2 de la tarde
CLASE 58 22 mayo 2020. Entrega de Trabajo final.
Primera vuelta 26 mayo 2020
los Alumnos que van hacer primera vuelta y reprobaron la unidad 1 deben repetir el examen con la parte que estuvo incorrecta
los Alumnos que van a hacer primera vuelta y reprobaron la segunda unidad, deben escoger 5 simuladores y realizar 5 ejercicios distintos a las tareas
los Alumnos que van hacer primera vuelta para subir calificación, entregar de la primera unidad al menos 2 ejercicios con los simuladores que elijan y al menos 3 ejercicios con simuladores de la unidad 2 que también elijan y si fuera el caso de reprobar la unidad 3 entregar 3 ejercicios con los simuladores que elijan
los ejercicios deben ser diferentes a los que se entregaron en cada evaluación
revisen sus calificaciones en el apartado final, ahi están sus resultados tentativos de evaluación y algunas indicaciones para cada alumno
Segunda vuelta 2 junio 2020
Entrega de calificaciones en actas 8 al 12 junio (que las pueden revistar siempre)
No hay fechas de exámenes extraordinarios
Fin de semestre 8 junio 2020