Introducción.
Todos los seres vivos están formados de agua, sin importar su tamaño, complejidad o forma; siempre de manera constante parece que uno de los requisitos fundamentales parece ser la presencia de esta molécula. Si bien su estructura es sencilla, su complejidad, importancia y belleza no recae en su simplicidad, sino en su estructura. Para darse una idea de su importancia tómese el siguiente ejemplo: El ser humano puede perder casi en su totalidad los niveles de grasa y la importante mitad de las proteínas en cada una de sus células y aún así permanecer vivo, pero la pérdida del 1-2% del agua corporal afecta a la termorregulación y a los sistemas cardiovascular y respiratorio, limitando la capacidad física y mental.1 Generando daños irreparables y costosos a la fisiología celular.
Cómo introducción y primer tema de esta página, se tiene la comprensión de la molécula del agua. Sus tópicos y temas que abarcan, darán pie a temas más extensos que se recapitularán en demás moléculas posteriores.
Composición y Estructura del agua.
Como ya se mencionó anteriormente, el agua es una molécula pequeña, simple; pero que alberga propiedades interesantes. Se forma únicamente de un átomo de oxígeno unido covalentemente a dos átomos de hidrógeno.1 Sin embargo, estos enlaces no se comportan como cualquier otro, el oxígeno es un átomo muy electronegativo, esto quiere decir que tiende a atraer mucho a los electrones de los átomos alrededor a éste; mientras que el hidrógeno es todo lo contrario. Esto genera una distribución no balanceada de los electrones. En otras palabras, la molécula posee una distribución irregular de la densidad electrónica, en donde el oxígeno tiene la mayor densidad electrónica (carga negativa) y cerca de los hidrógenos la menor densidad electrónica (carga positiva).2 Queriendo decir que los electrones se encontrarán más probablemente circundado al oxígeno en comparación al hidrógeno.
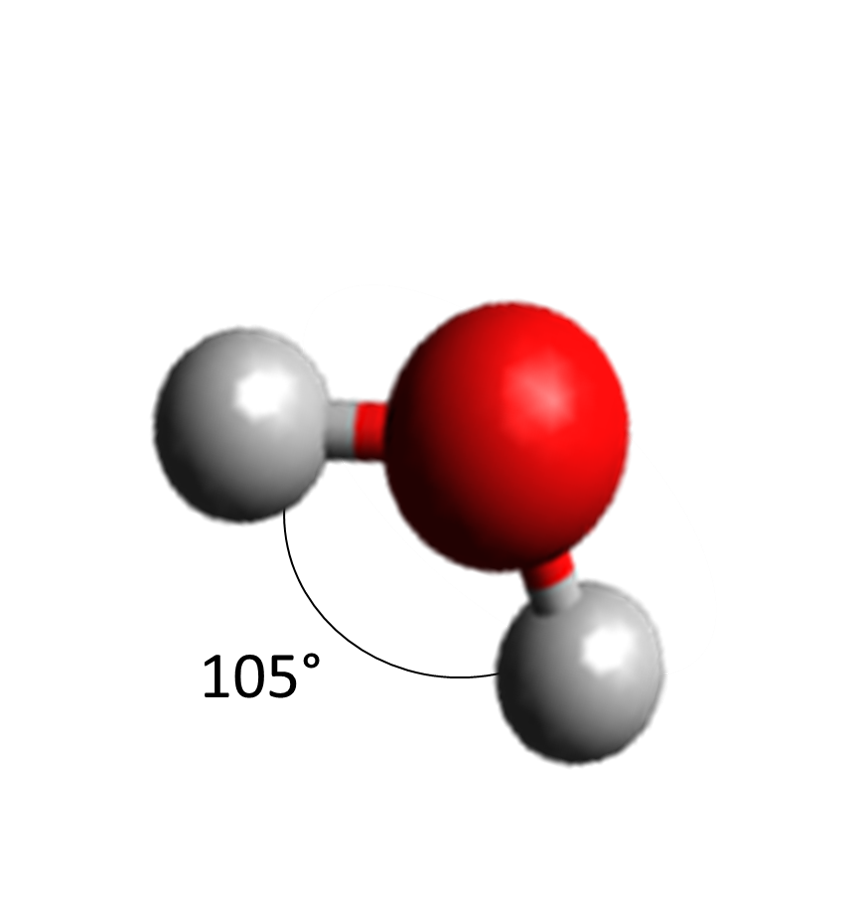
La geometría del agua posee un ángulo muy característico de 105° entre hidrógeno e hidrógeno. Recordando que el oxígeno tiene otros dos pares de electrones libres distribuidos, éstos pueden ser atraídos por otros dos hidrógenos de otra molécula de agua, mientras que los dos hidrógenos originales se atraen con otros dos átomos de oxigeno. Esto ocasiona que una molécula de agua puede formar cuatro puentes de hidrógeno con otras moléculas dando lugar a una estructura tetraédrica reticular ordenanda.2 Estos puentes de hidrógeno que se atraen fuertemente hacen que la molécula no se comporte de forma aislada y afecte su punto de ebullición. Esto quiere decir que la gran mayoría de las cualidades de la molécula de agua no se deben a la molécula en sí, sino a su interacción con las demás.
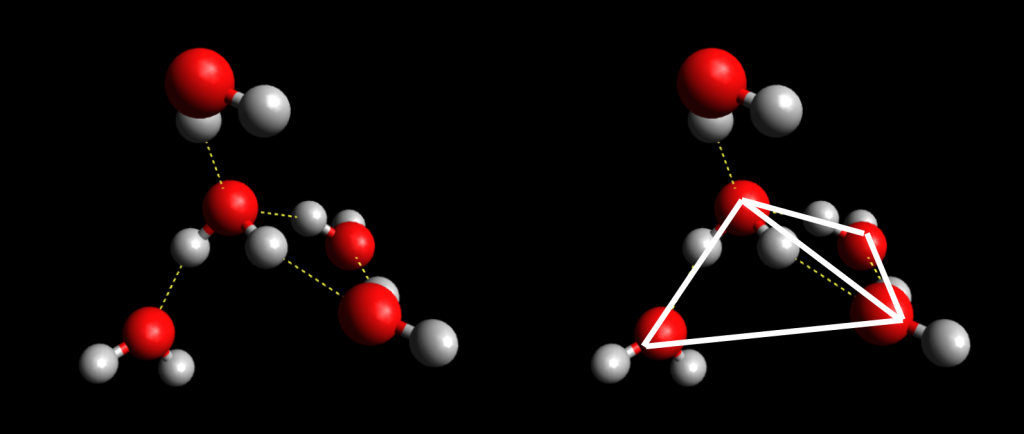
Estas interacciones le confieren características como su función de disolvente de gran cantidad de compuestos, su alto punto de ebullición, su estabilidad, polaridad y conductividad.
Función Termorreguladora.
La conductividad del agua permite regular el calor corporal, el organismo necesita equilibrar la cantidad de agua, mediante la ingesta de líquidos, cuando se suda demasiado el sistema circulatorio reduce el flujo de sangre a la piel, disminuye la sudoración y se pierde menos calor, y aumenta la temperatura corporal, que puede ocasionar daño a nuestro cuerpo1.
Los puentes de hidrógeno del agua se forman rápido y también se rompen, haciendo así la movilidad del agua, cuando se calienta el agua, estas moléculas se mueven más rápido y empiezan a escabullirse a la atmósfera, este aumento de energía hace que las fuerzas de atracción de las moléculas del agua se separen, para esta etapa se necesita calor, para transformar el agua de la forma líquida a la forma gaseosa.
Estructura cristalina Hielo.
La forma del agua en hielo es cuando sus moléculas se encuentran a 0°C, y no se rompen los puentes de hidrógeno, formando una red de enlaces rígidos llamada red cristalina.1
Todos los cristales de hielo tienen una estructura hexagonal, el ángulo que separa a los átomos de hidrógeno es de 104.5°en estado líquido, en estado sólido o sea hielo el Angulo de los puentes de hidrógeno es aproximadamente 109°, los hexágonos que se forman en el hielo no se encuentran alineados en una sola superficie unos pueden estar más arriba o más abajo3
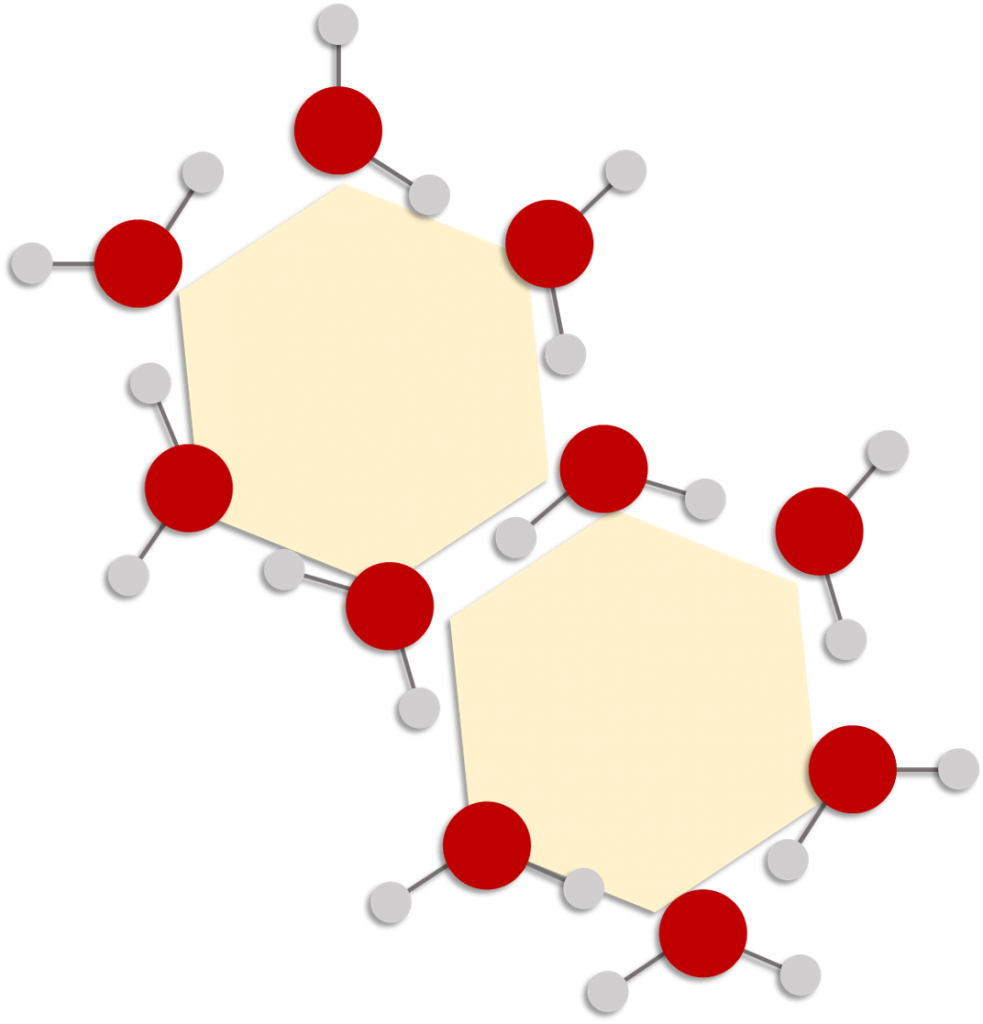
Figura 3. Arreglo “hexagonal” que adquieren las moléculas de agua a temperaturas cercanas a 0°C. Este fenómeno explica la razón de que todos los copos de nieve estén formados con patrones hexagonales.
La molécula de hielo se forma a cero grados centígrados a una atmosfera de presión, cada molécula de hielo forma cuatro enlaces de hidrógeno con otros cuatro hidrógenos de otra molécula de hielo con un enlace covalente O-H (ca. 0,98A) y de un enlace de hidrógeno (ca. 2,75A). Figura 4

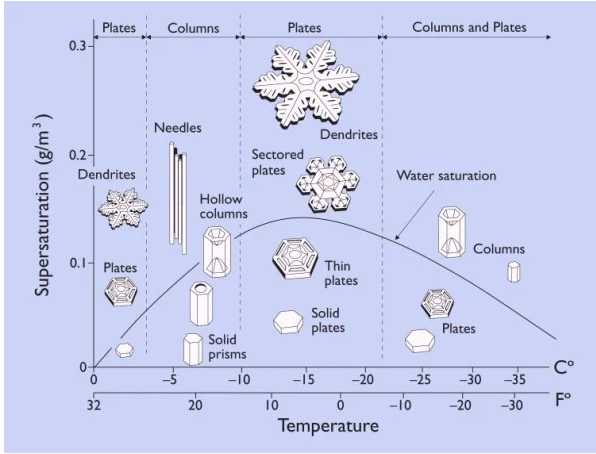
Cuando los cristales van creciendo, de cada esquina del hexágono se van haciendo nuevas ramificaciones formando figuras únicas; y esto va a depender de la temperatura y la humedad del medio. En la figura 5 se observa un diagrama realizado por Ukichiro Nakaya, que explica las características observables de cada cristal de hielo dependiento de la saturación de agua en el ambiente y de la temperatura.
Una de las propiedades más importantes del agua que se pueden derivar a partir de su estructura, es su capacidad de flotar sobre su propio líquido. En la gran mayoría de los casos, los sólidos de las sustancias son mucho más densos que sus líquidos, un ejemplo sencillo puede ser el chocolate. Si uno funde una tablilla de chocolate y por encima coloca una nueva, ésta se hundiría, pues es más densa. En el caso del agua aocurre lo contrario, los hielos de nuestras bebidas y refrescos flotan, esto se debe al arreglo geométrico que llegan a poseer. El arreglo hexagonal de la figura 3 deja ver que en el centro de cada hexágono hay un espacio vacío; ocasionando que las moléculas ocupen más espacio y por ende, menos densidad. Esto ocasiona que el hielo pueda flotar sobre el agua.
Las implicaciones de esto son de suma importanicia, durante las épocas de glaciación, al congelarse los lagos, el hielo se dirige a la superficie, ocasionando que únicamente se encuentre congelada el agua que entre directamente en contacto con el ambiente; manteniendo al resto del lago en su forma líquida permitiendo que animales y organismos puedan seguir viviendo.
Propiedades del agua como disolvente.
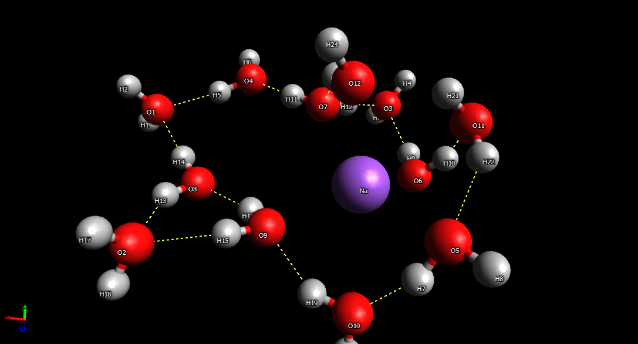
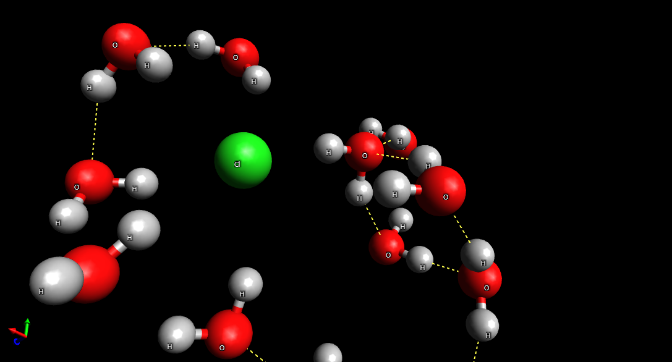
Un disolvente es una sustancia generalmente líquida que puede diluir a otras sustancias, dichas moléculas se llaman solutos, Las moléculas de agua pueden agruparse en torno a los iones o moléculas del soluto dispersándolos y manteniéndolos separados.1 Ésto únicamente es posible si dicho soluto posee una determinada polaridad, es decir que presente distribuciones irregulares en su carga (igual que cada molécula de agua). A las sustancias que pueden ser solubilizadas por el agua son llamadas hidrofílicas, mientras que, poir analgía; las demás son llamadas hidrofóbicas.1
En el caso se las figuras 6 y 7 se observa que las moléculas de agua se acomodan en torno a los iones dependiendo de su naturaleza. Por ejemploi, en el caso del sodio (figura 6) al tener una carga positiva en el agua (Na+), los oxígenos, que poseen una carga parcial negativa debido a su electronegatividad, se orientan hacia él. Y en el caso del cloro (figura 7), los hidrógenos se orientan hacia él.
Cohesión del agua
Las moléculas de agua siguen unidas entre ellas por sus puentes de hidrógeno. sin embargo, las moléculas de agua que están expuestas al aire por uno de sus lados, tendrán menos moléculas de agua con las cuales unirse y formaran uniones mas fuerte que dará la resistencia al agua para una ruptura o stress6, A lo que se llama tensión superficial. (ver figura 8). Una manerá didáctica de verlo, es imaginando que cada molécula de agua trata de “jalar” siempre a otra por medio de sus puentes de hidrógeno; a las moléculas que están justo en la superficie, tienen disponible una zona sin moléculas de agua que la “estén jalando”. Si se imagina a cada una de éstas moléculas que “jalan” como vectores de fuerza, se puede entonces hablar de una fuerza resultante. En el caso de una molécula rodeada de otras que aplican fuerza sobre ella, la resultante será negativa, porque todas están “jalando” con la misma fuerza. En el caso de las moléculas de la superficie, hay menos interacciones de un lado y esto ocasiona que se vean atraíadas hacia el centro.
Esta fuerza que atrae a todas las moléculas hacia el centro ocasiona las muy distintivas formas de las gotas de agua al caer, de las esferas perfectas que forma el agua en el espacio. Esta tensión superficial mantiene una cierta rigidez en la superficie que se puede puede observar cuando una piedra choca con el agua, cuando un mosquito camina sobre ella o cuando flota un barquito de papel.6

Referencias
1.- Starr, Taggart, Evers. Biología La unidad y la diversidad de la vida 12 edición 2009 28-29 editorial Cengage Learning.
2.- Carbajal, A. & González M. (2012). Agua para la Salud. Pasado, presente y futuro. Eds. CSIC recopilado desde: https://www.ucm.es/data/cont/docs/458-2013-07-24-Carbajal-Gonzalez-2012-ISBN-978-84-00-09572-7.pdf
3.-Libbrecht, K. (2019). Snow Crystals. Recopilado desde: http://www.snowcrystals.com/
4.- Nave, C. R. (2010). Tensión Superficial. Hyperphysics.com. Recuperado desde: http://hyperphysics.phy-astr.gsu.edu/hbasees/surten.html
5.- Marcus D Hanwell, Donald E Curtis, David C Lonie, Tim Vandermeersch, Eva Zurek and Geoffrey R Hutchison; “Avogadro: An advanced semantic chemical editor, visualization, and analysis platform” Journal of Cheminformatics 2012, 4:17.
6.- Khan Academy. (2019). La Cohesión del agua. Khan Academy.org. Recuperado desde: https://es.khanacademy.org/science/biology/water-acids-and-bases/cohesion-and-adhesion/a/cohesion-and-adhesion-in-water
7. Dreamstime. (2019). Imagen recuperada desde: https://www.dreamstime.com/photos-images/dreamstime.html