Los BME son importantes para el diseño del tamaño de aparatos que se emplean y para calcular su costo. Los cálculos de balance se basan en los principios de conservación de la materia y la energía. Sirven para:
- Determinar flujos, composiciones y temperaturas de todas las corrientes en un diagrama de flujo.
- Diseñar cada parte del equipo.
- Determinar los flujos y composiciones de las corrientes no medidas o no medibles en el proceso.
Cronología de aprendizaje Carrera de IQ-FES Zaragoza
CLASIFICACIÓN
De acuerdo con el tipo de régimen
La mayoría de los procesos industriales están basados en operaciones continuas, es decir, las corrientes entran y salen permanentemente del sistema en que se produce la transformación, sin etapas de carga y descarga. El régimen normal de funcionamiento de las operaciones continuas (excepto durante las puestas en marchao paradas) es el régimen estacionario, es decir, aquél en el que las variables no dependen del tiempo, manteniéndose los valores constantes durante el proceso. Esto no implica que las variables sean constantes, puesto que sus valores cambian con la posición, sino que en cada punto no se modifican a lo largo del período de funcionamiento de la operación (refino de petróleo, producción de amoníaco).
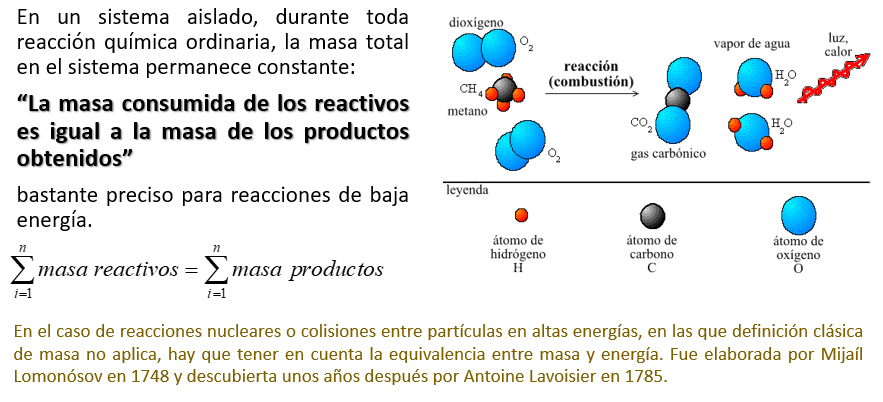
En efecto, durante una reacción o conjunto de reacciones químicas puede generarse o desaparecer un compuesto, pero nunca un elemento, por lo que en el segundo caso el término de generación siempre será nulo, tanto en unidades másicas como en unidades molares. Si se aplica el balance de componentes a un compuesto, se deberá contar con información sobre la cinética de la reacción química. Obsérvese finalmente que, si no hay reacciones químicas, los balances de materia pueden hacerse en unidades másicas o molares. Y es importante señalar que, si un sistema implica reacciones químicas, los balances de componentes y el balance total deben realizarse, preferentemente, en unidades molares.
Clasificación de balance de acuerdo con el sistema analizado
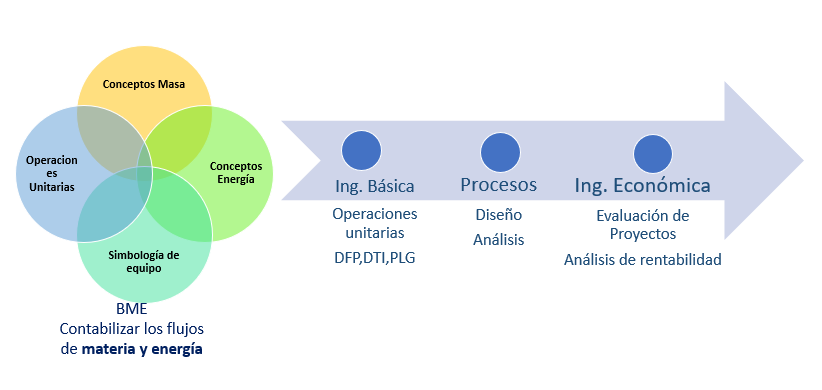
Los principios de conservación de la masa y de la energía de un sistema, constituyen la base de todos los cálculos de balance de materia y energía. Normalmente la forma en que se lleva a cabo el aprendizaje de estos es de manera gradual por lo cual normalmente se desarrollan en los cursos de la carrera de ingeniería química de la siguiente manera:

CONCEPTOS
El concepto de masa es una magnitud física que expresa la cantidad de materia de un cuerpo, medida por la inercia de este, que determina la aceleración producida por una fuerza que actúa sobre él. Es una propiedad intrínseca de los cuerpos que determina la medida de la masa inercial y de la masa gravitacional.

LEY DE LA CONSERVACIÓN DE LA MATERIA
La ley de la conservación de la materia dice que en cualquier reacción química la masa se conserva, es decir, la masa y la materia ni se crea ni se destruye, sólo se transforma y permanece invariable.
LEYES TERMODINÁMICAS
- Ley Cero de la Termodinámica
Si dos objetos A y B están separados térmicamente y cada uno en equilibrio térmico con un tercero C, entonces A y B están en equilibrio térmico entre ellos.
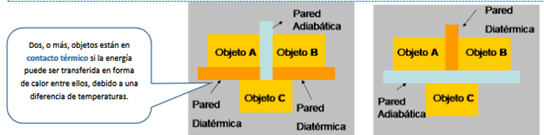
La temperatura (desde un punto de vista macroscópico) es la propiedad que determina si un objeto está (o no) en equilibrio térmico con otros objetos. Esto es, dos objetos en equilibrio térmico entre sí están a la misma temperatura. Si dos objetos tienen distintas temperaturas no están en equilibrio térmico entre sí.4
- Primera ley de la Termodinámica.
Planteamiento formal de ésta es:
“Aunque la energía tome muchas formas, la cantidad total de energía es constante, y cuando la energía desaparece en una forma, aparece simultáneamente en otra”.
Forma más básicas.
∆ Energía del sistema + ∆ Energía de alrededores = 0
Todo el intercambio de energía entre un sistema y sus alrededores se hace como calor y trabajo. Al reescribir este término en la ecuación anterior, resulta:
∆ Energía de alrededores= ±Q ±W
En dónde la elección de los signos depende de la dirección del transporte considerada como positiva.
Desarrollando el primer término para mostrar cambios de energía:
∆ Energía del sistema=∆Ut+ ∆Ek+ ∆Ep
Dónde:

Reacomodando los términos anteriores:
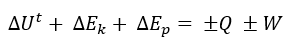
Aplicando la convención moderna del signo a Q y W, para un maquina térmicala ecuación anterior puede reescribirse como:
∆Ut+ ∆Ek+ ∆Ep= +Q-W
La mayoría de los sistemas de cerrados, no presentan cambios en su energía potencial y cinética, por lo cual, estos términos son “cero”. Eliminando estos términos de la ecuación anterior, resulta:
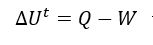
Reescribiendo la ecuación anterior en términos diferenciales, resulta:
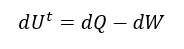
Aplicada a sistemas cerrados que experimentan cambios en su energía interna
- Segunda ley de la Termodinámica.
Dos enunciados más comunes estipulados en la segunda ley son:
- Ningún equipo puede funcionar de modo tal que su único efecto (en el sistema y sus alrededores) sea convertir completamente todo el calor absorbido por el sistema en trabajo hecho por el sistema.
- No existe ningún proceso que consista exclusivamente en la transferencia de calor de un nivel de temperatura a otro mayor.
- Tercera ley de la Termodinámica.
“La entropía absoluta es cero para todas las sustancias cristalinas perfectas a la temperatura del cero absoluto”.
La entropía absoluta, de un gas a Temperatura T, se obtiene de la resolución de ésta integral:
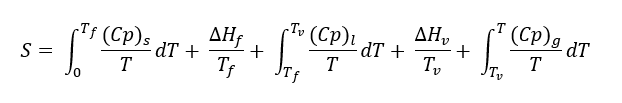
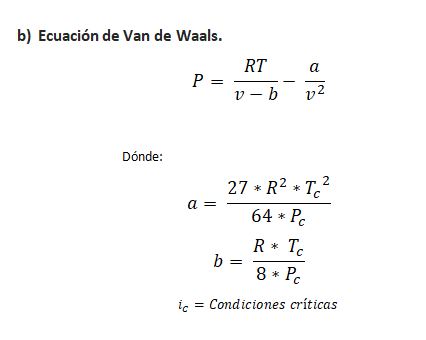
ECUACIONES DE ESTADO
Son aquellas ecuaciones que relacionan las propiedades de estado. Principalmente aquellas que son fáciles de medir, por ejemplo: La temperatura, presión y volumen. Por lo cual, también tenemos que definir que es un estado termodinámico, el cual se define como: un conjunto de propiedades termodinámicas.
Las principales ecuaciones de estado son:





DIAGRAMAS
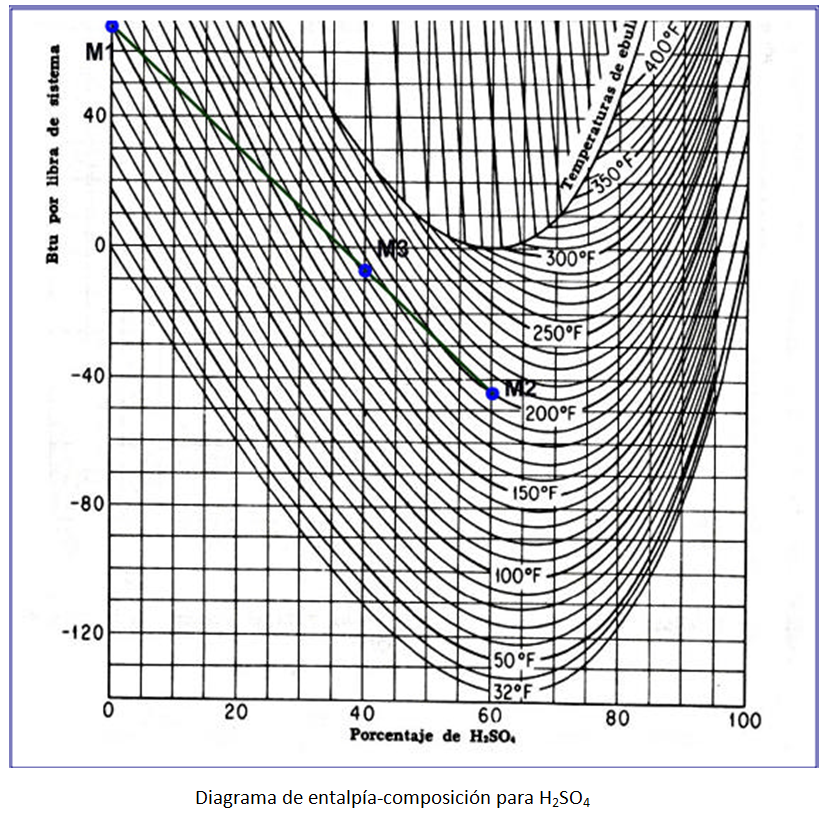
Entalpias vs Composición
ESTADO ESTACIONARIO
En el estado estacionario, hay una porción restringida del universo dentro de la cual no se observa acumulación neta de masa con respecto al tiempo, no obstante, recibe materia del medio y la descarga hacia el mismo a razón constante.
Homogeneidad de las ecuaciones de balance:
Las ecuaciones de balance son homogéneas en los flujos de las corrientes. Se llama homogéneo en un conjunto de variables a un sistema de ecuaciones en el que los valores de dicho conjunto pueden escalarse uniformemente, de manera que los valores de dicho conjunto pueden escalarse uniformemente, de manera que los valores resultantes sigan satisfaciendo las ecuaciones.
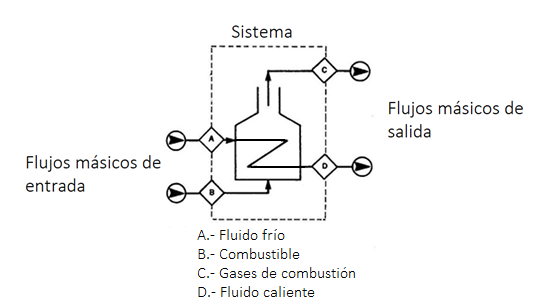
Base de cálculo:
Para plantear correctamente un balance de materia, tener homogeneidad de las ecuaciones de balance, a veces es aconsejable elegir previamente una cantidad a la cual referir todos los términos de dicho balance. Se denomina base de cálculo al valor numérico de una magnitud extensiva, generalmente sencillo (1, 100, 1.000, etc.), que se elige de forma arbitraria para facilitar los cálculos y sobre el cual están referidas otras magnitudes extensivas resultantes. La complejidad de los cálculos que habrá que realizar dependerá en gran medida del acierto en la elección de dicha base de cálculo. Aunque no existe una regla clara para su elección, como norma general puede tomarse el siguiente criterio de prioridad:
- Una cantidad de uno de los componentes del sistema, que no reaccione químicamente y que entre y salga del sistema formando parte de una sola corriente (100 kg de disolvente en una columna de absorción).
- Una cantidad de una de las corrientes que entre o salga del sistema, generalmente de la que se disponga de más información (100 kmol de aire en un horno de combustión).
- Un intervalo de tiempo (1 hora).
Balance de masa con acumulación:
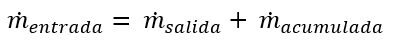
En estado estable, la acumulación dentro de los sistemas no existe, por lo tanto:
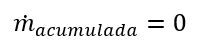
Por lo cual, el balance sin acumulación queda como:
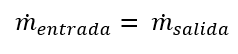
En términos de especies químicas por corriente: