Balances de masa con reacción química de combustión BM+RC
Se le denomina combustión a la reacción química durante la cual se oxida un combustible en presencia de aire en proporciones adecuadas, liberando gran cantidad de energía en forma de calor a una velocidad relativamente alta.
La mayoría de los combustibles conocidos se componen principalmente de carbono e hidrógeno, entrando en esta clasificación los hidrocarburos denotados con la fórmula general CnHm, los cuales se presentan en los tres estados de la materia. (Cengel & Boles, 2011).
Para que la reacción de combustión tenga lugar deben coexistir tres factores:
- Combustible, el cual principalmente es un hidrocarburo.
- Comburente, empleando con mayor frecuencia el aire y en casos particulares el oxígeno únicamente.
- Energía de activación, que es la energía necesaria para alcanzar la temperatura de ignición se obtiene generalmente de una chispa.
Estos tres factores conforman el denominado triángulo de la combustión como se muestra en la figura 1.1. (García, 2001).
Figura 1.1. Triángulo de la combustión
Tipos de reacciones de combustión.
En una reacción de combustión puede ser clasificada como completa o incompleta. Una combustión completa es aquella en la que todos los elementos que constituyen el combustible son oxidados en su totalidad, generándose compuestos como CO2, H2O, y S2O (en caso de existir). Por el contrario, en una combustión incompleta los componentes del combustible no se oxidan completamente dando lugar a productos como C, CO, OH, SO, H2 e incluso porciones del mismo combustible.
Si bien, una combustión incompleta es muy común en situaciones reales, la causa motivo, es la falta de insuficiencia de oxígeno en la reacción y por ello para asegurar una combustión completa se emplea mayor cantidad de aire requerida a la estequiométrica. En la tabla 1.1 se observan los casos posibles al efectuarse una reacción de combustión.
Tabla 1.1. Tipos de reacciones de combustión para un combustible hidrocarburo
| Reacción | Tipo de reacción | Comburente | Productos |
| CxHy + nO2à xCO2 + (y/2)H2O | Completa y Teórica. | O2 | CO2 yH2O |
| CxHy + n(O2 + 3.76N2)à CO2 + H2O + N2 | Completa y Teórica. | Aire | CO2, H2O y N2 |
| CxHy + n (O2 + 3.76N2)à CO2 + H2O + CO + N2 | Incompleta y Real (Deficiencia de Aire) | Aire | CO2, H2O, CO y N2 |
| CxHy + n(O2 + 3.76N2)à CO2 + H2O + CO + O2 + N2 | Completa y Real (Con Exceso de Aire) | Aire | CO2, H2O, CO, O2 y N2 |
Clasificación de los combustibles.
Actualmente, la clasificación de los combustibles puede realizarse bajo dos criterios simultáneos:
- De acuerdo con su origen: Siendo naturales o procesados
- En base al estado físico de la materia: Siendo sólidos, líquidos o gaseosos.
Tabla 1.2. Clasificación de los combustibles
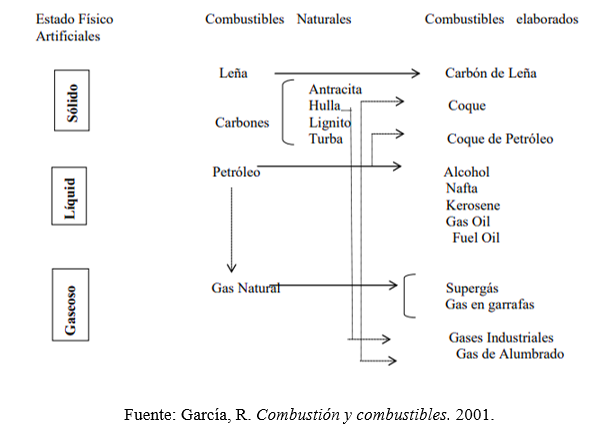
Propiedades de los combustibles hidrocarburos
Debido a que los combustibles derivados del petróleo existen en los tres estados de la materia, en general, son una mezcla de distintos componentes que hacen de sus propiedades únicas para cada área geográfica. De esta manera, los hidrocarburos más volátiles se vaporizan primero, formando lo que se conoce como gasolina, mientras que los combustibles menos volátiles que se obtienen durante la destilación son el queroseno, el diésel y el combustóleo. La composición de un combustible particular depende de la fuente de petróleo crudo, así como de la refinería. (Cengel& Boles,2011).
Para la elección del combustible es importante considerar las siguientes propiedades fundamentales:
- Poder calorífico: Cantidad de calor liberado cuando un combustible se quema por completo en un proceso de flujo estacionario, este poder calorífico depende de la fase del H2O en los productos, para lo cual se dividen en Poder Calorífico Superior (PSC) y Poder Calorífico Inferior (PCI)
- Temperatura de ignición: Temperatura mínima necesaria a la cual el combustible se mezcla con el aire en proporción adecuada para inflamarse y llevarse a cabo la combustión.

