Introducción
Esta actividad está orientada para los alumnos que quieran cuantificar Proteínas en Diente o en Orina. Analizar los componentes orgánicos de diente a través del método de Folin Ciocalteu para comprobar la presencia de proteínas.
Determinación de Proteínas en Diente
MATERIAL y REACTIVOS
Material:
8 Tubos de ensayo de 18 x 150
1 Gradilla
1 Pipeta de 10 ml
2 Pipetas de 5ml
4 Pipetas de 1 ml
1 Piseta con agua destilada
Papel milimétrico
Calculadora
Reactivos:
Solución alcalina (Na2CO3 al 4%, CuSO4 al 2%, tartrato de NaK al 4%)
Reactivo de Folin-Ciocalteu (RFC) diluido 1:2
Estándar de proteína de huevo de [1mg/ml]
Hidróxido de sodio 1.5N
Solución “O” por grupo (preparada de 7 a 15 días previos a la práctica con
4.5 – 5g de diente molido pesado en la balanza analítica + 25ml de HCl al
6N en un matraz volumétrico de 100ml)
Equipo
Espectrofotómetro
Vortex
Procedimiento
Aforar la solución “O” a 100ml ( Solución “O” por grupo (preparada de 7 a 15 días previos a la práctica con 4.5 – 5g de diente molido pesado en la balanza analítica + 25ml de HCl al
6N en un matraz volumétrico de 100ml)
- De esta solución pipetear 5.0ml y transferir a un matraz aforado de 100ml,
adicionar 5.0ml de Hidróxido de sodio 1.5N, homogeneizar esta solución y
anotar las características físicas, aforar esta solución y etiquetar como
solución “C” (solución problema)
Preparar una serie de 7 tubos etiquetando del 1 al 7 de la siguiente manera:
- Adicionar 5 ml de solución alcalina a cada tubo y mezclar. Dejar reposar a
temperatura ambiente durante 15 minutos. - Adicionar 0.5 ml de RFC y mezclar después de cada adición (no adicionar
RFC a más de un tubo, sin mezclar inmediatamente, ya que se podría
alterar el curso de la reacción). - Dejar reposar los tubos a temperatura ambiente durante 30 minutos para
desarrollo del color. - Calibrar el espectrofotómetro con el tubo 1 a 0% de absorbancia con una
longitud de onda de 660 nm y proceder a leer todos los tubos. En caso de
requerir la recalibración del espectrofotómetro se deberá utilizar
nuevamente el tubo 1.
A partir de los resultados obtenidos se debe calcular los equivalentes de proteína
en la muestra de diente y contrastarlos con el porcentaje referido en la bibliografía.
Para la realización de conversiones y cálculos puedes apoyarte en las tablas del
sistema de unidades, sistema cartesiano y ejemplo de problema de componentes
de diente que se encuentran como anexos de este manual.
Tabla Con Datos
| Tubo | Agua Destilada (ml) | Estándar de Proteína (ml) | Solución C Problema (ml) | Solución alcalina | Reposar 15 min | RFC | Reposar 30 min | Absorbancia | Cuantificación de Proteína |
| 1 | 1 ml | ——- | —— | 5 ml | 0.5ml | 0 | 0 | ||
| 2 | 0.9 ml | 0.1 ml | ——– | 5ml | 0.5ml | 0.12 | 0.1 | ||
| 3 | 0.8 ml | 0.2 ml | ——– | 5ml | 0.5ml | 0.24 | 0.2 | ||
| 4 | 0.7 ml | 0.3 ml | ——– | 5ml | 0.5ml | 0.34 | 0.3 | ||
| 5 | 0.6 ml | 0.4 ml | ——- | 5ml | 0.5ml | 0.43 | 0.4 | ||
| 6 | 0.5 ml | 0.5 ml | ——- | 5ml | 0.5ml | 0.51 | 0.5 | ||
| 7 | 0.5 ml | ——– | 0.5 ml | 5ml | 0.5ml | 0.16 | 0.11 | ||
| 8 | —- | —— | 1.0 ml | 5ml | 0.5ml | 0.24 | 0.22 |
Adicionar 5 ml de solución alcalina a cada tubo y mezclar. Dejar reposar a
temperatura ambiente durante 15 minutos.
- Adicionar 0.5 ml de RFC y mezclar después de cada adición (no adicionar
RFC a más de un tubo, sin mezclar inmediatamente, ya que se podría
alterar el curso de la reacción). - Dejar reposar los tubos a temperatura ambiente durante 30 minutos para
desarrollo del color. - Calibrar el espectrofotómetro con el tubo 1 a 0% de absorbancia con una
longitud de onda de 660 nm y proceder a leer todos los tubos. En caso de
requerir la recalibración del espectrofotómetro se deberá utilizar
nuevamente el tubo 1.
A partir de los resultados obtenidos se debe calcular los equivalentes de proteína
en la muestra de diente y contrastarlos con el porcentaje referido en la bibliografía.
Para la realización de conversiones y cálculos puedes apoyarte en las tablas del
sistema de unidades, sistema cartesiano y ejemplo de problema de componentes
de diente que se encuentran como anexos de este manual.
RESULTADOS
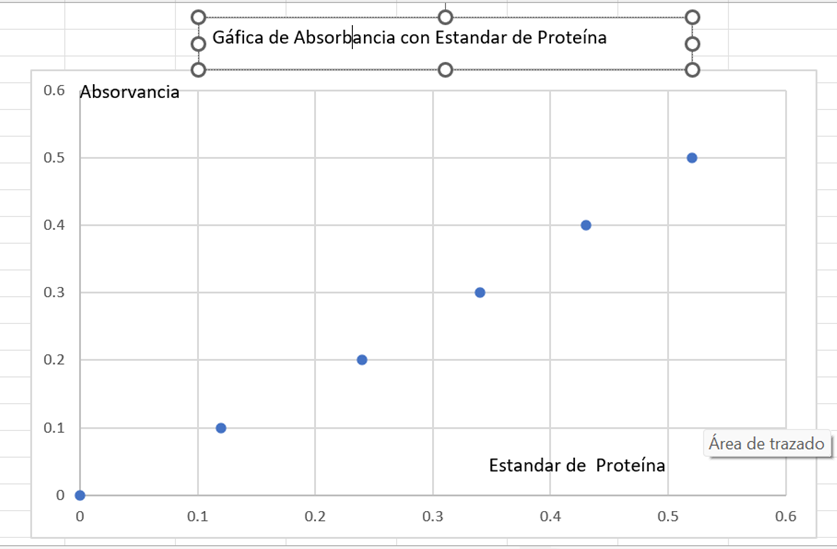
- Determinar los miligramos de diente que presenta la solución “O”
- Solución O
Peso del diente 5.0517g 1g_________1000mg
5.0517g______________________________X es igual 5051.7mg de diente
Solución C
5051.7 mg______________100ml
X——————————–5ml es igual 25.25mg de diente
25.25mg de diente____________5ml
2.- Determinar los miligramos de diente que presentan los tubos problema (7 y
8)
Tubo 7 25.25 mg de diente _________100ml
x———————————-0.5 ml es igual X es igual 0.12625 mg de diente
Tubo 8 25.25 mg de diente____ _________100ml
X______________________1ml es igual a 0.2525 mg de diente
3.- Una vez realizada la curva patrón, determinar la concentración de proteínas
en cada uno de los tubos problema (7 y 8).
Tubo 7 extrapolando salió 0.11 mg de proteína
Tubo 8 extrapolando en la gráfica sale 0.22 mg de proteína
Estándar de proteína es es 1 mg/ ml
4.- Reportar los en mg de proteína en la solución “C” así como el
porcentaje.
En 0.12625mg de diente hay 0.11 mg de proteína
en 25.25 mg de diente:_____________X__ es igual 22 mg de ptoteína
En la solución C hay 25.25mg de diente________________100%
22mg de diente__________________X es igual al 87.12%
5.-Reportar los mg de proteína en la solución “O” así como el
porcentaje.
En el tubo 7 hay 0.1265mg de diente-____________0.11 mg de proteína
En la solución O hay 5051.7mg de diente_____________X es igual 4392.78mg de proteína
5051.7mg de diente______________100%
4392.78mg de diente_____________X es igual a 87.12%
CUESTIONARIO
1.- ¿Cuál es la función de las proteínas en el diente?
Las funciones de las proteínas son específicas de cada una de ellas y permiten a las células mantener su integridad, defenderse de agentes externos reparar daños, controlar y regular funciones, etc. Todas las proteínas realizan su función de la misma manera, por unión selectiva a moléculas.
2.- ¿Cuáles son las proteínas que encontramos en diente y cuál de ellas se
encuentra en mayor cantidad?
Glicoprotínas, son moléculas compuestas por una proteína unida a uno o varios glúcidos. Tienen como función el reconocimiento celular. Dentro de estas glucoptoteinas encontramos sialoproteínas específicas de dentina.
3.- ¿Cuáles son las concentraciones de proteínas citadas en diversas
bibliografías?
4.- ¿En qué otras estructuras del Sistema Estomatognático se encuentran las
proteínas?
El sistema estomatognático del Griefo stoma boca y gnathos mandibula, se refiere a las estructuras de la boca, se encuentran en labios, encias.
BIBLIOGRAFÍA
Bohinski, R. C.: Bioquímica. Editorial Fondo Educativo Interamericano, 1978.
Bhagaban, N.V.: Bioquímica 2ª edición, Editorial Interamericana, México, 1978.
Burnett, G.W.: Scherp, H.”.: Schuster, G.S.: Oral Microbiology and Infectious
disease. 4ª editions. Ed. The Williams 7 “. Co., Baltimore U.S.A. 1976
Jenkins, G.N.: Fisiología y Bioquímica Bucal, 1ª edición, Editorial Limusa,
México, 1983.
Voet, D., Pratt, C.: Fundamentos de Bioquímica: la vida a nivel molecular, 4ª
edición. Ed. Médica Panamericana, México, 2016.
Williams. Elliot: Bioquímica dental básica y aplicada, 2ª edición. Editorial Manual
Moderno, México 1990
Método de cuantificación de proteína en líquidos corporales
Determinación cuantitativa de proteínas totales en orina y
LCR
Fundamento
Las proteínas presentes en la muestra reaccionan en medio ácido con el rojo pirogalos y el molibdato, forman un complejo coloreado, la intensidad de color formado es proporcional a la concentración de proteínas en la muestra.
SIGNIFICADO CLÍNICO
La orina de personas sanas no contiene proteínas ó sólo pequeñas cantidades, normalmente el
glomérulo evita el paso de éstas de la sangre al filtrado glomerular. Alteraciones glomerulares causan el aumento de la permeabilidad de las proteínas plasmáticas lo que ocasiona la proteinuria, que indica presencia de proteínas en orina.
La presencia persistente de proteinuria indica enfermedad renal. Concentraciones elevadas de proteínas en líquido cefalorraquídeo (LCR) pueden ser debidas a infecciones o a presión intracraneal.
REACTIVOS
R Rojo pirogalol , Molibdato sódico50 µmol/L,0,04 mmol/L
Patrón primario acuoso de Albúmina/Globulina 1000 mg/L
1000 mg/L
Absorbancia (A) del Blanco a 598 nm ≥ 0,70.
MATERIAL ADICIONAL
Espectrofotómetro ó analizador para lecturas a 598 nm.
Celda
MUESTRAS
Orina de 24 h: Estable 8 días a 2-8ºC.
Líquido cefalorraquídeo (LCR): Estable 4 días a 2-8ºC.
PROCEDIMIENTO
| Tubos | Rojo pirogalol | Patrón microlitros | Muestra microlitros | mezclar e incubar 5 min a 37 grados centígrados | Leer | |
| 1 | Blanco Patrón Muestra | |||||
| 2 | 1 ml | |||||
| 3 | 1 ml | 20 | ||||
| 4 | 1 ml | 20 |
CÁLCULOS
Proteína en Orina
Absorbancia muestra- Absorbancia Blanco /Absorbancia Patrón – Absorbancia Blanco X 1000 X volumen de L de orina 24 horas
Proteína en Líquido Cefaloraquideo
Absorbancia muestra- Absorbancia Blanco /Absorbancia Patrón – Absorbancia Blanco X 1000 concentración Patrón es igual mg/L de proteína
VALORES DE REFERENCIA
Orina: < 100 mg/24 h (en mujeres embarazadas < 150 mg/24 h) LCR: Niños 300 -1000 mg/L Adultos 150 – 450 mg/L Estos valores son orientativos. Es recomendable que cada laboratorio establezca sus propios valores de referencia.
BIBLIOGRAFÍA
Orsonneau JL et al. An improved Pyrogallol Red-Molybdate Method for
Determining Total Urinary Protein. Clin Chem 1989; 35:2233-2236.
Koller A. Total serum protein. Kaplan A et al. Clin Chem The C.V. Mosby
Co. St Louis. Toronto. Princeton 1984; 1316-1324 and 418.
Young DS. Effects of drugs on Clinical Lab. Tests, 4th ed AACC Press,
1995.
Young DS. Effects of disease on Clinical Lab. Tests, 4th ed AACC 2001.
Burtis A et al. Tietz Textbook of Clinical Chemistry, 3rd ed AACC 1999.
Tietz N W et al. Clinical Guide to Laboratory Tests, 3rd ed AACC 1995

